Konsep, proses, dan contoh sublimasi
- 3855
- 1134
- Pete Lesch
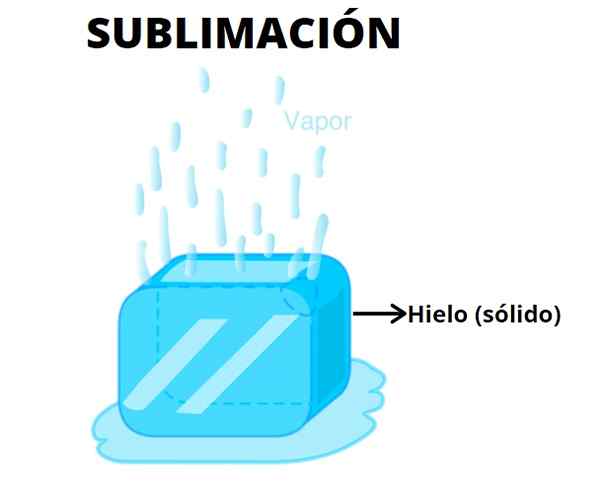
Itu sublimasi Ini adalah proses termodinamika di mana perubahan keadaan endotermik terjadi langsung dari padatan ke gas, tanpa pembentukan cairan sebelumnya. Contoh luar biasa dari proses ini adalah es kering; Saat terpapar matahari atau terbenam dalam cairan, ia beralih langsung dari keadaan padatan ke gas.
Perilaku padatan dalam kondisi normal adalah memanas dan berasal dari setetes pertama, di mana lebih banyak partikel padat larut sampai benar -benar meleleh. Sementara itu, dalam sublimasi ada pembicaraan tentang "gelembung", uap progresif tanpa membasahi permukaan yang menyentuh, tetapi segera disimpan atau mengkristal.
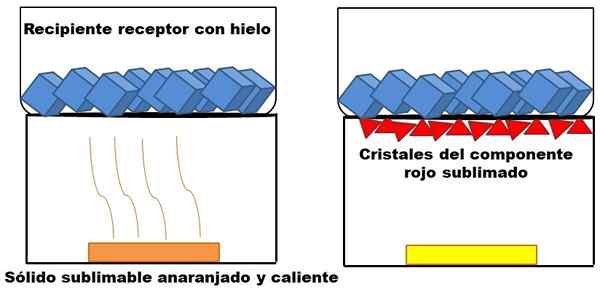
 Contoh sublimasi padatan oranye hipotetis. Sumber: Gabriel Bolívar.
Contoh sublimasi padatan oranye hipotetis. Sumber: Gabriel Bolívar. Apa yang dijelaskan dalam paragraf atas diwakili dalam gambar superior. Misalkan campuran padatan oranye (kiri), yang mulai meningkatkan energinya dengan meningkatkan suhu. Komponen merah sublimal, dan kemudian disimpan di bagian bawah wadah penerima, yang suhunya lebih rendah karena es batu dalam kandungannya.
Segitiga atau kristal merah disimpan berkat permukaan dingin wadah ini (kanan), yang menyerap suhunya; Dan bahkan jika tidak ditampilkan, ukuran es batu harus berkurang karena penyerapan panas. Sisa padatan memiliki komponen kuning yang tidak dapat diterbitkan dalam kondisi proses.
[TOC]
Konsep Sublimasi
Proses
Telah dikatakan bahwa sublimasi adalah perubahan keadaan endotermik, karena agar, harus ada penyerapan panas. Jika padatan menyerap panas energinya akan meningkat, maka partikelnya juga akan bergetar pada frekuensi yang lebih besar.
Ketika getaran ini menjadi sangat kuat, mereka akhirnya mempengaruhi interaksi antar molekul (bukan ikatan kovalen); Dan akibatnya, cepat atau lambat partikel akan mengambil lebih banyak jarak dari satu sama lain, sampai mereka berhasil mengalir dan bergerak lebih bebas melalui daerah ruang angkasa.
Dapat melayani Anda: aturan diagonalDalam beberapa padatan, getarannya sangat kuat, sehingga beberapa partikel "dipicu" di luar struktur alih -alih aglomerasi dalam kelompok seluler yang menentukan setetes. Partikel -partikel ini melarikan diri dan mengintegrasikan "gelembung" pertama, yang lebih suka membentuk uap pertama dari padatan yang disublimasikan.
Itu kemudian diucapkan bukan tentang titik leleh, tetapi sublimasi. Sementara keduanya tergantung pada tekanan yang berkuasa pada padatan, titik sublimasi lebih; Oleh karena itu, suhunya bervariasi dengan perubahan tekanan (seperti halnya dengan titik didih).
Dari struktur padat hingga gangguan gas
Dalam sublimasi juga dikatakan bahwa ada peningkatan entropi sistem. Keadaan energi partikel berubah dari dibatasi oleh posisi tetap mereka dalam struktur padat, menjadi homogenisasi dalam arah yang berubah -ubah dan kacau dalam keadaan gas, lebih seragam, di mana mereka akhirnya memperoleh energi kinetik rata -rata.
Diagram fase dan triple point
Titik sublimasi tergantung pada tekanan; Karena sebaliknya, partikel padat akan menyerap panas untuk tidak ditembakkan ke ruang di luar padatan, tetapi untuk membentuk tetes. Itu tidak akan disublimasikan, tetapi akan meleleh atau meleleh, seperti yang paling biasa.
Semakin besar tekanan eksternal, semakin kecil kemungkinan sublimasinya, karena padatan untuk meleleh berkewajiban.
Tetapi padatan mana yang bisa disuapkan dan mana yang tidak? Jawabannya terletak pada diagram p vs t Anda, seperti yang ditunjukkan di bawah ini:
Dapat melayani Anda: neon: sejarah, sifat, struktur, risiko, penggunaan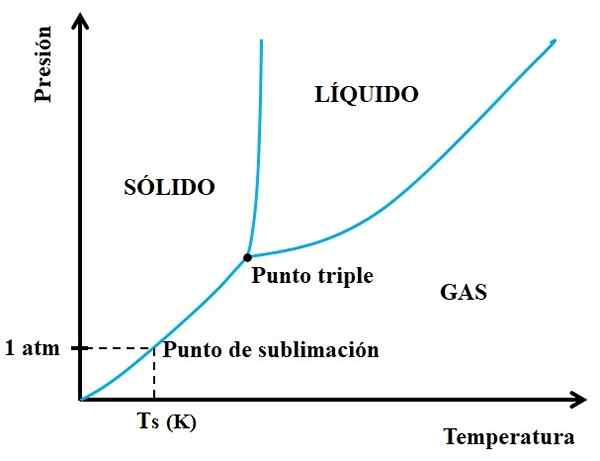 Diagram fase untuk zat hipotetis. Sumber: Gabriel Bolívar.
Diagram fase untuk zat hipotetis. Sumber: Gabriel Bolívar. Anda harus melihat pertama di triple point dan bepergian ke peregangan yang lebih rendah: yang memisahkan keadaan padat dan gas. Perhatikan bahwa di wilayah padat, harus ada penurunan tekanan sehingga sublimasi terjadi (tidak harus 1 tekanan atmosfer). A 1 atm, zat hipotetis akan Sublim pada suhu TS yang dinyatakan dalam k.
Semakin lama bagian atau kurva di bawah titik tiga, semakin besar kapasitas padatan ke sublim pada suhu yang berbeda; Tetapi jika jauh di bawah 1 atm, maka akan diperlukan dengan celah tinggi untuk mencapai sublimasi, sehingga tekanan berkurang (0,0001 atm, misalnya).
Kondisi
Jika triple point ribuan kali lebih rendah dari tekanan atmosfer, padatan tidak akan pernah sublim atau bahkan menerapkan ultra -kehidupan (belum lagi kerentanannya untuk terurai dengan aksi panas).
Jika ini bukan masalahnya, sublimasi dilakukan dengan cara secara moderat, dan mengirimkan padatan ke ruang hampa sehingga partikel mereka lebih mudah keluar, tanpa perlu menyerap begitu banyak panas.
Sublimasi menjadi sangat penting ketika mereka terutama padat dengan tekanan uap tinggi; yaitu, tekanan di dalam, refleksi dari efisiensi interaksinya. Semakin besar tekanan uapnya, semakin bau, dan juga lebih mudah dibiarkan.
Contoh
Pemurnian yang solid
Gambar padatan oranye dan komponen kemerahannya yang sublimen adalah contoh dari apa yang mewakili sublimasi mengenai pemurnian padat. Segitiga Merah dapat diabaikan kembali sebanyak yang diperlukan sampai kemurnian tinggi dijamin.
Dapat melayani Anda: spatula laboratoriumTeknik ini digunakan terutama dengan padatan yang harum. Misalnya: Kamper, Kafein, Benzoine dan Mentol.
Di antara padatan lain yang dapat mendasari sublimasi yang kita miliki: yodium, es (di ketinggian besar), Theobromine (cokelat), sakarin, morfin dan obat -obatan lainnya, basis nitrogen dan antrasena.
Sintesis kristal
Kembali ke segitiga merah, sublimasi menawarkan alternatif untuk kristalisasi konvensional; Kristal tidak akan lagi disintesis dari larutan, tetapi dengan cara.
Katakanlah, jika mereka memiliki kotak merah, pertumbuhan kristal akan mempertahankan geometri ini dan tidak boleh menjadi segitiga. Kotak merah secara bertahap akan tumbuh saat sublimasi terjadi. Namun, ini adalah kompleks operasional dan sangat kompleks, di mana banyak variabel yang terlibat terlihat.
Contoh kristal yang disintesis melalui sublimasi adalah: silicon carbide (sic), grafit, arsenik, selenium, fosfor, aluminium nitruro (ALN), kadmium sulfida (CDS), seng seleniuro (znse), merkuri iodide (HGI)2), graphene, antara lain.
Perhatikan bahwa mereka benar -benar dua fenomena kompenered: sublimasi dan deposisi progresif (atau sublimasi terbalik); Uap beremigrasi dari daerah padat ke daerah atau permukaan, untuk akhirnya menyimpan dalam bentuk kristal.
Tema yang menarik
Contoh Sublimasi.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2019). Sublimasi (transisi fase). Diperoleh dari: di.Wikipedia.org
- Jones, Andrew Zimmerman. (27 Januari 2019). Sublimasi. Pulih dari: thinkco.com
- Sheila Morrissey. (2019). Apa sublimasi dalam kimia? - Definisi, Proses & Ujian. Belajar. Pulih dari: belajar.com
- Elsevier b.V. (2019). Metode sublimasi. Ilmiah. Diperoleh dari: Scientedirect.com
- « Karakteristik subkadusifolio hutan tropis, flora, fauna
- Sifat integral intefined, aplikasi, perhitungan (contoh) »

