Karakteristik Tyrosine, Struktur, Fungsi, Manfaat
- 4985
- 1052
- Leland Robel
Itu Tyrosine (Tyr, y) adalah salah satu dari 22 asam amino yang membentuk protein dari semua sel yang ada pada makhluk hidup. Tidak seperti asam amino lainnya seperti valin, treonine, tryptophan, leusin, lisin dan lainnya, tirosin adalah asam amino esensial yang "bersyarat" pada dasarnya.
Nama "Tyrosine" berasal dari kata Yunani "penembakan", Yang berarti keju, karena asam amino ini pertama kali ditemukan dalam makanan ini. Istilah ini diciptakan pada tahun 1846 oleh Liebig, yang mencampur keju dengan kalium hidroksida dan memperoleh senyawa yang tidak diketahui, hampir tidak larut dalam air.
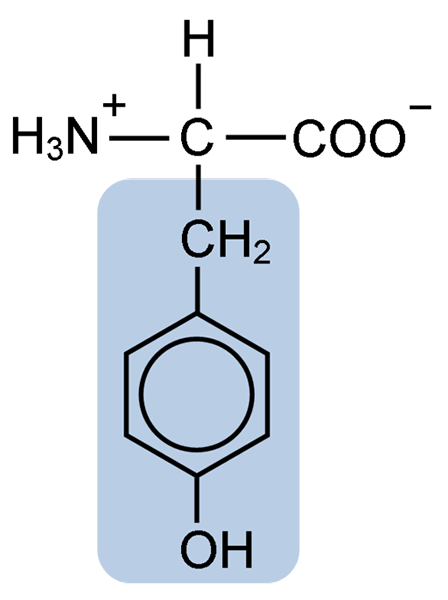
 Struktur kimia asam amino tirosin (sumber: clavecin [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Struktur kimia asam amino tirosin (sumber: clavecin [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) Setelah deskripsi awal, peneliti lain seperti Warren de la Rue dan Hinterberger yang diperoleh dari serangga kokoid dan protein tanduk, masing -masing. Pemisahannya dari hidrolisis protein lain dengan asam klorida dijelaskan pada tahun 1901 oleh Mörner.
Secara umum, asam amino ini diperoleh pada mamalia berkat hidroksilasi fenilalanin, meskipun juga diserap dalam usus dari protein yang dikonsumsi dengan makanan.
Tyrosine memiliki banyak fungsi dalam tubuh manusia dan di antara ini yang paling relevan adalah, mungkin, substrat untuk produksi neurotransmiter dan hormon seperti adrenalin dan hormon tiroid.
[TOC]
Karakteristik
Tyrosine berbobot sekitar 180 g/mol dan kelompok rantai r atau sampingnya memiliki konstanta 10 -Disosiasi 10.07. Kelimpahan relatif dalam protein sel tidak melebihi 4%, tetapi memiliki beberapa fungsi penting untuk fisiologi manusia.
Asam amino ini termasuk dalam kelompok asam amino aromatik, di mana fenilalanin dan triptofan juga bersifat. Anggota kelompok ini memiliki cincin aromatik dalam rantai rr atau sampingnya dan, biasanya, mereka adalah asam amino hidrofobik atau apolar.
Seperti tryptophan, tirosin menyerap cahaya ultraviolet dan merupakan salah satu limbah asam amino yang bertanggung jawab untuk absorbansi cahaya hingga 280 nm banyak protein, sehingga berguna untuk karakterisasinya.
Ini dianggap sebagai asam amino "kondisional" yang penting karena biosintesisnya pada manusia tergantung pada fenilalanin, asam amino esensial. Jika tubuh memenuhi persyaratan harian fenilalanin, tirosin dapat disintesis tanpa masalah dan bukan asam amino yang membatasi.
Namun, jika diet kurang fenilalanin, tubuh tidak hanya akan memiliki ketidakseimbangan asam amino ini, tetapi juga tirosin. Penting juga untuk menunjukkan bahwa reaksi sintesis tirosin dari fenilalanin tidak dapat dibalik, sehingga tirosin tidak dapat memenuhi kebutuhan seluler fenilalanin.
Tyrosine juga termasuk dalam kelompok asam amino dengan fungsi ganda dalam produksi perantara metabolik glukogenik dan ketogenik, yang berpartisipasi dalam sintesis glukosa untuk otak dan dalam pembentukan tubuh keton di hati.
Struktur
Seperti sisa asam amino, tirosin, atau asam β-parahydroxyphenyl-α-amino propionic, itu adalah asam α-amino yang memiliki atom karbon sentral, yang disebut karbon α dan yang merupakan kiral, karena terkait dengan Empat atom atau molekul substituen yang berbeda.
Karbon quiral ini terkait dengan dua kelompok karakteristik asam amino: gugus amino (NH2) dan kelompok karboksil (COOH). Dia juga berbagi salah satu ikatannya dengan atom hidrogen dan ikatan yang tersisa ditempati oleh r rantai r atau samping dari masing -masing asam amino.
Dalam kasus tirosin, kelompok ini terdiri dari cincin aromatik yang terkait dengan kelompok hidroksil (OH), yang memberikan kemampuan untuk membentuk jembatan hidrogen dengan molekul lain dan yang memberikannya karakteristik fungsional penting untuk enzim tertentu.
Itu bisa melayani Anda: baroreseptorFungsi
Tyrosine adalah komponen mendasar dari banyak protein dengan keragaman aktivitas dan fungsi biologis yang besar.
Pada manusia dan mamalia lainnya, asam amino ini dimanfaatkan dalam jaringan saraf dan ginjal untuk sintesis dopamin, adrenalin dan norepinefrin, tiga neurotransmiter terkait katekolaminergik terkait yang paling penting untuk fungsi tubuh tubuh tubuh.
Ini juga penting untuk sintesis pelindung radiasi ultraviolet (UV) seperti melanin; dari beberapa analgesik seperti endorfin dan molekul antioksidan seperti vitamin E.
Demikian pula, asam amino ini berfungsi untuk sintesis hormon tiramine, octopamine, dan tiroid melalui organisasi yodium dalam residu tirosin tirosin tiramlobulin.
Tiramine adalah molekul vasoaktif yang ditemukan dalam tubuh manusia dan gurita adalah amina yang terkait dengan noreprenalin.
Semua fungsi tirosin ini dimungkinkan berkat memperoleh dari protein diet atau dengan hidroksilasi fenilalanin dengan hati sebagai sistem utama pasokan sistemik asam amino tersebut.
Fungsi di tanaman
Tyrosine dan beberapa perantara yang dihasilkan selama biosintesis mereka memberi makan rute biosintetik metabolit yang berspesialisasi dalam pertahanan, dalam daya tarik penyerbuk, dalam transportasi elektronik dan dukungan struktural.
Biosintesis
Pada manusia, tirosin diperoleh dari diet atau disintesis dalam satu langkah oleh sel -sel hati dari fenilalanin, asam amino esensial, melalui reaksi yang dikatalisis oleh kompleks enzimatik fenilalanin hidroksilase enzimatik fenilalanin.
Kompleks ini memiliki aktivitas oksigenase dan hanya ada di hati manusia atau mamalia lainnya. Reaksi sintesis tirosin menyiratkan, kemudian, transfer atom oksigen ke posisi untuk cincin aromatik fenilalanin.
Reaksi ini terjadi pada saat yang sama bahwa molekul air terbentuk karena pengurangan atom oksigen molekul lain dan daya pereduksi dikontribusikan secara langsung oleh NADPH yang dikonjugasikan dengan molekul tetrahidropterin, yang mirip dengan asam folat.
Biosintesis pada tanaman
Pada tanaman, tirosin disintesis dari novo Hilir dari rute "Shikimato", yang memberi makan rute biosintesis lainnya dari asam amino aromatik lainnya seperti fenilalanin dan triptofan.
Dalam organisme ini, sintesis ini didasarkan pada senyawa yang dikenal sebagai "corismato", yang merupakan produk akhir dari rute Shikimato dan, di samping itu, prekursor umum untuk semua asam amino aromatik, vitamin tertentu dan hormon tanaman tertentu.
Corismate diubah menjadi kata pengantar oleh aksi katalitik enzim mutasa corismate dan ini adalah langkah "yang dilakukan" pertama dalam sintesis tirosin dan fenilalanin pada tanaman.
Predeneate dikonversi menjadi tirosin oleh dekarboksilasi oksidatif dan transaminasi, yang dapat terjadi dalam urutan apa pun.
In one of the biosynthetic routes, these steps can be catalyzed by specific enzymes known as prefenate-specific dehydrogenase (PDH) (which converts the preface into 4-hydroxyphenylpyphenylpyruvate (HPP)) and tyrosine aminotransferase (which produces the tyrosine from the HPP ), masing -masing.
Jalur lain dari sintesis tirosin dari kata pengantar menyiratkan transaminasi predeneat ke asam amino non-proteinogenik yang disebut L-arogenat, dikatalisis oleh enzim preenate aminotransferase preenate preenate.
L-arogenat selanjutnya dikenakan dekarboksilasi oksidatif untuk membentuk tiroksin, reaksi yang diarahkan oleh dehidrogenase spesifik tyrosine arogenat, juga dikenal sebagai ADH.
Tanaman secara istimewa menggunakan rute arenate, sementara sebagian besar mikroba mensintesis tirosin dari HPP yang berasal dari predenesat.
Peraturan
Seperti berlaku untuk sebagian besar rute biosintetik asam amino, tanaman memiliki sistem regulasi yang ketat tentang sintesis asam amino aromatik, termasuk tirosin.
Dapat melayani Anda: monster lezat: karakteristik, habitat, perawatan, propertiDalam organisme ini, regulasi terjadi di banyak tingkatan, karena mekanisme yang mengendalikan rute Shikimato juga mengontrol produksi tirosin, rute yang juga ada mekanisme regulasi mereka sendiri.
Namun, persyaratan tirosin dan, oleh karena itu, kekakuan dalam regulasi biosintesis mereka, khusus untuk setiap spesies tanaman.
Degradasi
Degradasi atau katabolisme tirosin menghasilkan pembentukan fumarat dan asetoasetat. Langkah pertama dari rute ini terdiri dari konversi asam amino menjadi 4-hydroxyphenylpypypate oleh enzim sitosol yang dikenal sebagai aminotransferase tirosin.
Asam amino ini juga dapat ditransaminasi dalam mitokondria hepatosit oleh enzim aminotransferase aspartat, meskipun enzim ini tidak terlalu penting dalam kondisi fisiologis normal.
Melalui degradasi tirosin, succinyl-asetoacetate dapat terjadi, yang dapat didekarboksilasi menjadi sukinil-asetat. Succinyl-asetat adalah inhibitor enzim paling kuat yang bertanggung jawab untuk sintesis gugus hemo, asam asam 5-aminolevulin dehidratae 5-aminolevulin.
Sintesis adrenalin dan norepinefrin
Seperti disebutkan, tirosin adalah salah satu substrat utama untuk sintesis dua neurotransmiter yang sangat penting untuk tubuh manusia: adrenalin dan norepinefrin.
Ini awalnya digunakan oleh enzim yang dikenal sebagai hidroksilase tirosin, yang mampu menambahkan gugus hidroksil tambahan ke cincin aromatik dari kelompok tirosin R RI, yang membentuk senyawa yang dikenal sebagai DOPA.
DOPA memunculkan dopamin setelah diproses secara enzimatik oleh enzim Dopa Decboxilas.
Dopamin kemudian dikonversi menjadi noreprenalin dengan aksi enzim dopamin β -oksidase, yang mengkatalisasi penambahan gugus hidroksil ke -Ch yang merupakan bagian dari kelompok R dari tyrosine dan yang berfungsi sebagai "jembatan" antara cincin aromatik dan karbon α.
Adrenalin berasal dari norepinefrin dengan aksi fenythanolamine N-Methyltransferase, yang bertanggung jawab atas transfer S-adenosyl-metionine yang bergantung pada gugus metil (-CH3) ke gugus amino bebas norepinefrin.
Makanan Kaya Tirosin
Seperti disebutkan di atas, tirosin adalah asam amino "bersyarat" penting, karena disintesis dalam tubuh manusia dengan hidroksilasi fenilalanin, asam amino esensial.
Oleh karena itu, jika asupan fenilalanin mencakup tuntutan tubuh, tirosin bukan merupakan faktor pembatas untuk fungsi normal sel. Namun, tirosin juga diperoleh dari protein yang dikonsumsi dengan makanan sehari -hari.
Beberapa penelitian melaporkan bahwa asupan harian minimum kedua tirosin dan fenilalanin harus antara 25 dan 30 mg per kilogram berat, sehingga rata -rata orang harus mengkonsumsi lebih atau kurang 875 mg tirosin per hari.
Makanan dengan kandungan tirosin yang lebih tinggi adalah keju dan kedelai. Di antaranya juga adalah daging sapi, domba, babi, ayam dan ikan.
Beberapa biji dan kacang -kacangan seperti kacang -kacangan juga memberikan kontribusi yang signifikan dari asam amino ini, serta telur, produk susu, biji -bijian dan sereal.
Manfaat Asupan Anda
Tyrosine umumnya dikonsumsi dalam bentuk suplemen makanan atau nutrisi, khususnya untuk pengobatan patologi yang dikenal sebagai fenilcetonuria, diderita oleh pasien yang tidak dapat memproses fenilalanin dengan benar dan, oleh karena itu, tidak menghasilkan tirosin.
Itu dapat melayani Anda: fungsi hubunganDiperkirakan bahwa peningkatan jumlah tirosin yang dikonsumsi per hari dapat meningkatkan fungsi kognitif yang berkaitan dengan pembelajaran, memori, dan peringatan dalam kondisi stres, karena katabolismenya terkait dengan sintesis adrenalin dan neurotransmiter norepineniaal.
Beberapa orang menggunakan tablet kaya tirosin agar tetap waspada di siang hari jika mereka kehilangan banyak jam tidur.
Karena asam amino ini berpartisipasi dalam pembentukan hormon tiroid, konsumsinya dapat memiliki efek positif pada regulasi metabolisme sistemik.
Gangguan Kekurangan
Albinisme dan Alcaptonuria adalah dua patologi yang terkait dengan metabolisme tirosin. Kondisi pertama terkait dengan sintesis melanin yang rusak dari tirosin dan yang kedua berkaitan dengan cacat dalam degradasi tirosin.
Albinisme ditandai oleh kurangnya pigmentasi di kulit, yaitu, pasien yang menderita memiliki rambut putih dan kulit merah muda, karena melanin adalah pigmen yang bertanggung jawab untuk memberikan warna pada struktur ini.
Patologi ini berkaitan dengan kekurangan tyrosinase spesifik melanosit, yang bertanggung jawab untuk mengubah tirosin menjadi dopa-quinone, perantara dalam sintesis melanin.
Gejala Alcaptonuria terbukti sebagai pigmentasi urin yang berlebihan (gelap) dan artritis perkembangan akhir.
Patologi metabolisme lainnya
Selain itu, ada gangguan lain yang terkait dengan metabolisme tirosin, di antaranya adalah:
- Tyrosinemia herediter tipe I: ditandai dengan degenerasi hati progresif dan disfungsi ginjal
- Tyrosinemia herediter dari sindrom Tipe II atau Richner-Hanhart: yang terbukti sebagai keratitis dan lesi ampuler di telapak tangan dan sol kaki kaki
- Tyrosinemia Tipe III: yang bisa tanpa gejala atau hadir sebagai penundaan mental
- "Hawkinsinuria": ditandai dengan asidosis metabolik pada masa kanak -kanak dan ketidakmampuan untuk makmur dalam pertumbuhan
Ada juga cacat bawaan lain dalam metabolisme metrosin yang berkaitan dengan defisiensi dalam enzim yang bertanggung jawab atas degradasi mereka, seperti hidroksilase tirosin, yang bertanggung jawab atas langkah pertama sintesis dopamin dari tirosin.
Referensi
- Aders Plimmer, R. (1908). Konstitusi kimia protein. aku pergi. London, Inggris: Longmans, Green, dan CO.
- Chakrapani, a., Gissen, hlm., & McKiernan, P. (2012). Gangguan metabolisme tirosin. Di dalam Keinginan metabolisme bawaan: diagnosis dan perawatan (hal. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Aspek -aspek tertentu dari metabolisme tirosin pada kaum muda. yo. Pengembangan sistem pengoksidasi tirosin di hati manusia. Jurnal Investigasi Klinis, 35(10), 1089-1093.
- Du, b., Zannoni, v., Laster, l., & Seegmiller, E. (1958). Sifat cacat dalam metabolisme tirosin di alkaptonuria. Jurnal Kimia Biologis, 230, 251-260.
- Murray, r., Bender, d., Botham, k., Kennelly, hlm., Rodwell, v., & Weil, p. (2009). Biokimia Illustrated Harper (Edisi ke -28.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Prinsip -prinsip biokimia lehninger. Edisi Omega (Edisi ke -5.).
- Schenck, c. KE., & Maeda, h. KE. (2018). Biosintesis tirosin, metabolisme, dan katabolisme pada tanaman. Fitokimia, 149, 82-102.
- Slominski, a., Zmijewski, m. KE., & Paweley, J. (2012). L-Tyrosine dan L-Dihydroxyphenylalanine sebagai regulator seperti hormon fungsi melanosit. Penelitian sel pigmen dan melanoma, 25(1), 14-27.
- Van de, g. (2018). Jalur Kesehatan. Diperoleh 16 September 2019, dari www.Garis kesehatan.com
- Web MD. (N.D.). Diperoleh 15 September 2019, dari www.Webmd.com
- Whitbread, d. (2019). Data makanan saya. Diperoleh 15 September 2019, dari www.Myfooddata.com

