Struktur toluena, sifat, penggunaan, mendapatkan
- 4358
- 787
- Pete Lesch
Dia Toluena Itu adalah hidrokarbon aromatik yang formula kentalnya c6H5Ch3 atau phch3 Dan itu terdiri dari kelompok metil (CH3) bersama dengan cincin benzenik atau gugus fenil (pH). Secara alami ditemukan dalam minyak mentah, di batubara, di emanasi gunung berapi dan di beberapa pohon, seperti Tolú de América di selatan.
Pelarut bau karakteristik ini terutama digunakan sebagai bahan baku industri, dan sebagai pengencer cat. Ini juga digunakan dalam penghapusan parasit yang ada pada kucing dan anjing, seperti ascarid dan anylostome.
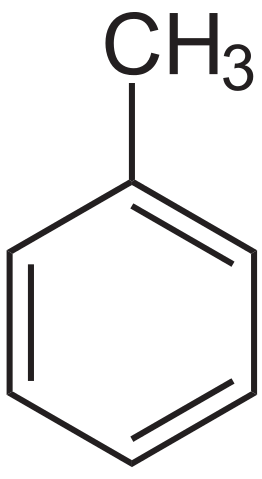
 Formula struktural toluena. Sumber: Neurotoger via Wikipedia.
Formula struktural toluena. Sumber: Neurotoger via Wikipedia. Toluena diisolasi untuk pertama kalinya oleh Pierre-Joseph Pelletier dan Philippe Walter, pada tahun 1837, dari minyak pinus. Selanjutnya, Henri Etienne Sainte-Claire Deville, pada tahun 1841, mengisolasinya dari Tolú Balm dan menunjukkan bahwa produknya mirip dengan yang sebelumnya terisolasi. Pada tahun 1843, Berzelius membaptisnya sebagai Toluin.
Sebagian besar toluena diperoleh sebagai produk lateral atau sekunder dalam proses produksi gas dan konversi batubara menjadi kokas. Ini juga diproduksi oleh reaksi yang dibuat di laboratorium, misalnya, reaksi benzena dengan metil klorida.
[TOC]
Struktur
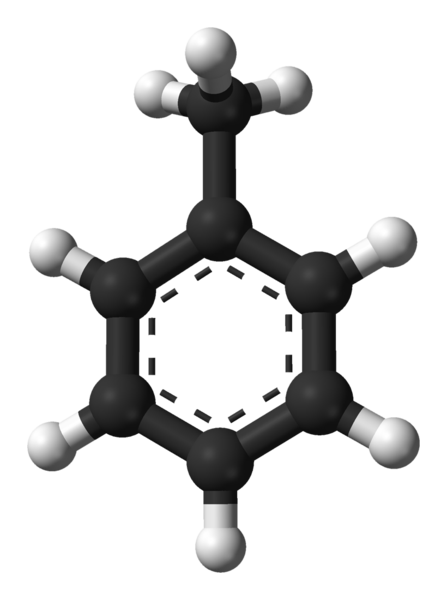 Struktur molekul toluena. Sumber: Ben Mills via Wikipedia.
Struktur molekul toluena. Sumber: Ben Mills via Wikipedia. Dalam gambar superior kita memiliki struktur molekul toluena yang diwakili oleh model bola dan batang. Perhatikan bahwa itu terlihat persis sama dengan formula struktural yang ditunjukkan, dengan perbedaan bahwa itu bukan molekul datar sepenuhnya.
Di tengah cincin benzena, yang dalam hal ini dapat dilihat sebagai gugus fenil, pH, karakter aromatiknya disorot melalui garis putus -putus. Semua atom karbon memiliki hibridisasi SP2, Kecuali untuk grup Cho3, yang hibridisasi SP3.
Karena alasan inilah molekul tidak sepenuhnya datar: co hidrogen3 Mereka terletak di berbagai sudut bidang cincin benzen.
Dapat melayani Anda: konstanta ionisasiToluena adalah molekul apolar, hidrofobik dan aromatik. Interaksi antarmolekulnya didasarkan pada kekuatan dispersif London, dan dalam interaksi dipolo-dipolo, karena pusat cincin "dimuat" dari kepadatan elektronik yang disediakan oleh CH3; Sedangkan atom hidrogen memiliki kepadatan elektronik yang rendah.
Oleh karena itu, toluena memiliki beberapa jenis interaksi antarmolekul yang menjaga molekul kohesif cairnya. Ini tercermin dalam titik didihnya, 111 ° C, yang tinggi mengingat itu adalah pelarut apolar.
Properti
Penampilan fisik
Cairan tidak berwarna dan transparan
Masa molar
92.141 g/mol
Bau
Manis, acre dan mirip dengan benzena
Kepadatan
0,87 g/ml pada 20 ºC
Titik lebur
-95 ºC
Titik didih
111 ºC
Kelarutan
Toluena memiliki kelarutan tercela dalam air: 0,52 g/L pada 20 ° C. Ini karena perbedaan polaritas antara toluena dan air.
Di sisi lain, toluena larut, atau dalam hal ini larut, dengan etanol, benzena, etil eter, aseton, kloroform, asam asetat glasial dan karbon disulfida; Artinya, lebih baik terlarut dalam pelarut polar yang kurang.
Indeks refraksi (nD)
1.497
Zat yang lengket dan kental
0,590 cp (20 ºC)
titik pengapian
6 ºC. Toluena harus dimanipulasi di kamp -kamp yang mengekstraksi gas dan sejauh mungkin dari api.
Kepadatan uap
3.14 dalam hubungan udara = 1. Artinya, uapnya tiga kali lebih padat dari udara.
Tekanan uap
2.8 kPa pada 20 ° C (sekitar 0.27 ATM).
Suhu diri sendiri
480 ° C
Penguraian
Dapat bereaksi dengan penuh semangat dengan bahan pengoksidasi. Saat dipanaskan untuk dekomposisi, ia memancarkan asap dan asap yang menjengkelkan.
Tegangan permukaan
29,46 mn pada 10 ºC
Momen dipolar
0,36 d
Reaktivitas
Toluena rentan terhadap klorinasi untuk menghasilkan ortho-chlorotoluene dan para-cllorotoluene. Juga mudah di -nitrifikasi untuk menghasilkan nitrotoluene, yang merupakan bahan baku pewarna.
Dapat melayani Anda: berat atomBagian toluena dikombinasikan dengan tiga bagian asam nitrat menyebabkan trinitrotoluene (TNT): salah satu bahan peledak paling terkenal.
Demikian juga, toluena mengalami sulfonasi untuk menghasilkan asam O-Toluen-Sulfonic dan P-Toluen-sulfonat, yang merupakan bahan baku untuk pembuatan pewarna dan sakarin.
Kelompok metil toluena mengalami kehilangan hidrogen karena aksi basa yang kuat. Kelompok metil juga rentan terhadap oksidasi, sehingga bereaksi dengan kalium permanganat menyebabkan asam benzoik dan benzaldehida berasal.
Aplikasi
Industrialis
 TNT, peledak paling simbolis dari semua, terjadi oleh toluena sebagai bahan baku utama. Sumber: Pixabay.
TNT, peledak paling simbolis dari semua, terjadi oleh toluena sebagai bahan baku utama. Sumber: Pixabay. Toluena digunakan dalam elaborasi lukisan, pengencer cat, kuku yang dipoles, perekat atau gusi pasta, lacquers, tinta, nilon, plastik, busa poliuretan, sebagian besar minyak, organ vinil, obat -obatan, pewarna, perfume, bahan peledak (TNT).
Dengan cara yang sama, toluena digunakan dalam bentuk toluenosulfonados dalam pembuatan deterjen. Toluena juga sangat penting dalam pembuatan semen plastik, taruhan pewarnaan kosmetik, antibeku, tinta, aspal, penanda permanen, semen kontak, dll.
Pelarut dan pengencer
Toluena digunakan dalam pengenceran lukisan, yang memfasilitasi aplikasinya. Ini digunakan untuk melarutkan tepi kit polystyrene, sehingga memungkinkan penyatuan bagian -bagian yang merupakan model pesawat skala pesawat. Selain itu, digunakan dalam ekstraksi produk alami dari tanaman.
Toluena adalah pelarut tinta yang digunakan dalam lubang terukir. Semen dicampur dengan karet dan toluena digunakan untuk menutupi sejumlah besar produk. Demikian juga, toluena digunakan sebagai pelarut pada tinta cetak, pernis, penyamak kulit, lem dan desinfektan.
Dapat melayani Anda: penyerap molarDan yang lebih menarik, toluena digunakan sebagai pelarut nanomaterial karbon (seperti nanotube) dan fullerenos.
Yang lain
Campuran benzena, toluena dan xilena (BTX) ditambahkan ke bensin untuk meningkatkan oktannya. Toluena adalah aditif gas pesawat dan cadangan oktan tinggi. Ini juga digunakan dalam elaborasi NAFTA.
Toluene membantu dalam penghapusan beberapa spesies ascárides dan anquilostomos, serta tenia yang merupakan parasit kucing dan anjing.
Memperoleh
Sebagian besar toluena diperoleh dari produk suling dari minyak mentah, dihasilkan selama pirolisis hidrokarbon (retak uap). Reformasi katalitik uap minyak mewakili 87 % dari toluena yang diproduksi.
Tambahan 9 % toluena dari bensin pirolisis yang diproduksi selama pembuatan etilena dan propilena.
Tar hulla oven kokas berkontribusi 1 % dari toluena yang diproduksi, sedangkan 2 % sisanya diperoleh sebagai produk sampingan dari pembuatan peregangan.
Efek merusak
Toluena adalah pelarut yang dihirup untuk menjadi tinggi, karena memiliki aksi narkotika yang mempengaruhi fungsi sistem saraf pusat. Toluena memasuki tubuh untuk konsumsi, inhalasi dan penyerapan melalui kulit.
Pada tingkat paparan 200 ppm, eksitasi, euforia, halusinasi, persepsi yang terdistorsi, sakit kepala dan pusing dapat terjadi. Sementara kadar paparan toluena yang lebih tinggi dapat menghasilkan depresi, kantuk dan kebodohan.
Saat inhalasi melebihi konsentrasi 10.000 ppm, mampu menghasilkan kematian individu karena gagal pernapasan.
Referensi
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Pusat Nasional Informasi Bioteknologi. (2020). Toluena. Database pubchem., CID = 1140. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2020). Toluena. Diperoleh dari: di.Wikipedia.org
- TOOLBOX ENGINEERING, (2018). Toluena - Sifat termofisik. [Online] Dipulihkan Dari: EngineeringToolbox.com
- Vedantu. (S.F.). Toluena. Pulih dari: vedantu.com
- « Formula dan persamaan interferensi yang merusak, contoh, olahraga
- Struktur Polyvinylirolidone, Sifat, Penggunaan, Efek Samping »

