Karakteristik Typtophan, Struktur, Fungsi, Manfaat
- 4231
- 918
- Jessie Harvey
Dia Tryptophan (TRP, W) adalah asam amino yang diklasifikasikan dalam kelompok asam amino esensial, karena organisme manusia tidak dapat mensintesisnya dan harus mendapatkannya melalui diet.
Beberapa makanan seperti susu dan turunannya, daging, telur dan beberapa sereal seperti quinoa dan kedelai mengandung asam amino esensial dan, oleh karena itu, merupakan sumber penting triptofan.
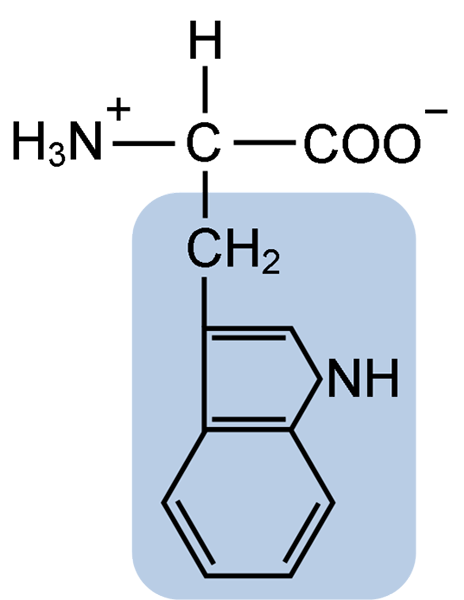
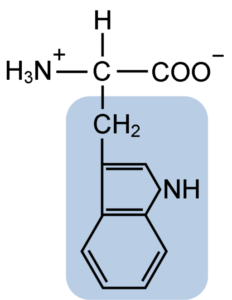 Struktur Kimia Asam Amino Typtophan (Sumber: Clavecin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Struktur Kimia Asam Amino Typtophan (Sumber: Clavecin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) Di alam, lebih dari 300 asam amino yang berbeda diketahui dan hanya 22 yang merupakan unit monomer protein sel. Di antara yang terakhir, 9 adalah asam amino esensial, termasuk triptofan, bagaimanapun, esensialitas masing -masing berbeda antara satu spesies dan lainnya.
Tryptophan memiliki berbagai fungsi, di antaranya partisipasi mereka dalam sintesis protein, dalam sintesis serotonin, yang merupakan vasokonstriktor dan neurotransmitter yang kuat, dari melatonin dan dalam sintesis co -founder NAD.
Di Kerajaan Tanaman, Tryptophan adalah prekursor mendasar dari hormon tanaman yang dikenal sebagai auksin (asam indol-3-asetat). Itu dapat disintesis oleh beberapa bakteri seperti DAN. coli Dari corismato, yang dihasilkan dari beberapa turunan glikolitik seperti fosfoenoliruvat dan erythrosa-4-fosfat.
Degradasinya pada mamalia terjadi di hati, di mana ia digunakan untuk sintesis asetil koenzim A (asetil-KoA), dan untuk alasan ini digambarkan sebagai asam amino yang disebut glukogenik, karena dapat memasuki siklus pembentukan glukosa.
Berbagai penelitian telah dilaporkan dengan hasil kontroversial terkait dengan penggunaan tryptophan sebagai suplemen makanan untuk pengobatan beberapa patologi seperti depresi dan beberapa gangguan tidur.
Ada beberapa penyakit yang terkait dengan cacat bawaan dalam metabolisme asam amino. Dalam kasus Typtophan, penyakit Hartnup dapat ditunjuk, karena tryptophan -2,3 -monoxigenase, penyakit herediter resesif yang ditandai dengan keterbelakangan mental dan perubahan jenis pelagra jenis kulit.
[TOC]
Karakteristik
Bersama dengan fenilalanin dan tirosin, triptofan ditemukan pada kelompok asam amino aromatik dan hidrofobik.
Namun, tryptophan ditandai dengan menjadi asam amino yang sedikit hidrofobik karena rantai samping aromatiknya, dengan memiliki gugus kutub, melemahkan hidrofobisitas itu.
Untuk memiliki cincin gabungan, mereka memiliki penyerapan cahaya yang kuat di daerah spektrum yang dekat dengan ultraviolet dan karakteristik ini sering digunakan untuk analisis struktural protein.
Ini menyerap cahaya ultraviolet (antara 250 dan 290 nm) dan, meskipun asam amino ini tidak terlalu melimpah dalam struktur sebagian besar protein tubuh manusia, kehadirannya merupakan kontribusi penting untuk kapasitas penyerapan cahaya cahaya di wilayah tersebut 280 nm sebagian besar protein.
Persyaratan harian tryptophan berbeda dengan usia. Pada bayi antara 4 dan 6 bulan, persyaratan rata -rata adalah sekitar 17 mg per kilogram berat badan per hari; Pada anak -anak berusia 10 hingga 12 tahun, 3,3 mg per kilogram berat per hari dan pada orang dewasa adalah 3,5 mg per kilogram berat per hari.
Tryptophan diserap oleh rute usus dan merupakan asam amino ketogenik dan glikogenik pada saat yang sama.
Karena ini adalah prekursor serotonin, neurotransmitter yang penting, triptofan harus mencapai sistem saraf pusat (SSP) dan untuk ini harus melintasi sawar darah otak, yang mana ada mekanisme transportasi aktif yang spesifik.
Dapat melayani Anda: Biggy Agar: Foundation, Persiapan dan PenggunaanStruktur
Tryptophan memiliki formula molekul C11H12N2O2 dan asam amino esensial ini memiliki rantai samping aromatik.
Seperti semua asam amino, tryptophan memiliki atom karbon α yang melekat pada gugus amino (NH2), atom hidrogen (H), gugus karboksil (COOH) dan rantai samping (R) yang dibentuk oleh struktur heterosiklik, kelompok indol Indol.
Nama kimianya adalah asam 2-amino-3-propionic, memiliki massa molekul 204,23 g/mol. Kelarutannya pada 20 ° C adalah 1,06 g dalam 100 g air dan memiliki kepadatan 1,34 g/cm3.
Fungsi
In the human being, the tryptophan is used for protein synthesis and is indispensable for serotonin formation (5-hydroxitriptamine) a powerful vasoconstrictor, stimulating the smooth muscle contraction (especially in the small intestine) and a neurotransmitter capable of Generate psychic stimulation, combat depression dan mengatur kecemasan.
Tryptophan adalah prekursor dalam sintesis melatonin dan, oleh karena itu, memiliki implikasi dalam siklus tidur dan vigil.
Asam amino tersebut digunakan sebagai prekursor dalam salah satu dari tiga cara untuk pembentukan kofaktor NAD, kofaktor yang sangat penting yang berpartisipasi dalam berbagai reaksi enzimatik yang terkait dengan peristiwa reduksi oksida.
Tryptophan dan beberapa prekursornya digunakan untuk pembentukan hormon vegetasi yang disebut auksin (asam indol-3-aktif). Auksin adalah hormon tanaman yang mengatur pertumbuhan, perkembangan dan banyak fungsi fisiologis tanaman lainnya.
Biosintesis
Dalam organisme yang mampu mensintesisnya, kerangka karbon tryptophan berasal dari fosfoenolpyruvat dan erythrosa-4-fosfat. Ini, pada gilirannya, dibentuk dari perantara siklus Krebs: oxalacetate.
Fosfoenoliruvat dan eriterus-4-fosfat digunakan untuk sintesis corismate pada rute enzimatik tujuh. Fosfoenoliruvat (PEP) adalah produk glikolisis dan eritrous-4-fosfat dari rute pentosa fosfat.
Bagaimana rute sintesis corismate?
Langkah pertama dari gejala corismato adalah penyatuan pep dengan erythrosa-4-fosfat untuk membentuk 2-zo-3-disoxxi-d-anabino-heptulosonato-7-fosfat (DAHP) (DAHP).
Reaksi ini dikatalisis oleh enzim 2-zo-3-dexxi-d-anabino-heptulosonato-7-fosfat sintase (DAHP sintasa), yang dihambat oleh korismat.
Reaksi kedua menyiratkan loslasi DAHP oleh sintase dehydrochinate, enzim yang membutuhkan co -factor nad, yang dikurangi selama reaksi ini; Akibatnya, 5-dishydroquinate terjadi.
Langkah ketiga dari rute ini menyiratkan penghapusan molekul air 5-dehydroquinate, reaksi yang dikatalisis oleh enzim dehidratase dehydrochinate, yang produk akhirnya sesuai dengan 5-Dishydro Shikimatato 5-Dishydro Shikimato.
Kelompok keto molekul ini direduksi menjadi kelompok hidroksil dan, sebagai akibatnya, shikimato terbentuk. Enzim yang mengkatalisasi reaksi ini adalah dependelia yang bergantung pada NADPH.
Langkah kelima dari rute ini menyiratkan pembentukan 5-fosfat shikimate dan konsumsi molekul ATP oleh enzim yang dikenal sebagai kinase shikimato, yang bertanggung jawab atas fosforilasi shikimate di posisi 5.
Selanjutnya, dari 5-fosfat shikimate dan oleh aksi 3-enlappiruvil shikimato-5-fosfat synthase, 3-enlappiruvil shikimato 5-fosfat dihasilkan. Enzim yang disebutkan di atas mempromosikan perpindahan gugus fosforil dari molekul PEP kedua oleh gugus karbon hidroksil pada posisi 5 dari 5-fosfat shikimate.
Itu dapat melayani Anda: mengapa penting untuk mengurus keanekaragaman hayati?Reaksi ketujuh dan terakhir dikatalisis oleh sintase corism, yang menghilangkan fosfat dari 3-enlappate shikimate 5-phosphate dan membuatnya corismate.
Di jamur N. Crassa, Kompleks enzimatik multifungsi tunggal mengkatalisasi lima dari tujuh reaksi dari rute ini dan kompleks ini ditambahkan tiga enzim lain yang akhirnya menghasilkan tryptophan.
Sintesis triptofan pada bakteri
Di dalam DAN. coli, Transformasi Corism Tryptophan mencakup lima rute enzimatik tambahan:
Pertama, enzim sintase antranilate mengubah corismate menjadi antranilate. Dalam reaksi ini molekul glutamin berpartisipasi, disumbangkan oleh kelompok amino yang berikatan dengan cincin indol triptofan dan menjadi glutamat.
Langkah kedua dikatalisis oleh fosforribosil transferase antranilasi. Dalam reaksi ini molekul pirofosfat dari 5-fosforribosil-1-pirofosfat (PRPP) (PRPP) bergerak kaya energi, dan N- (5'-fosforribosil) terbentuk terbentuk.
Reaksi ketiga dari rute sintesis tryptophan ini menyiratkan partisipasi enzim fosforribosil-isomerase. Di sini N- (5'-phorribosyl) -santhranylate.
Kemudian indole-3-gliserol fosfat terbentuk, dalam reaksi yang dikatalisis oleh sintase sympati-gliserol Indol-3, di mana molekul CO2 dan H2O dilepaskan dan 1- (O-carboxyphenylamine) -1- desoxyribulosa 5-phosphate.
Reaksi terakhir dari rute ini akhirnya membentuk tryptophan saat tryptophan synthase katalyz.
Degradasi
Pada mamalia, tryptophan terdegradasi di hati menjadi asetil-KoA pada rute yang melibatkan dua belas langkah enzimatik: delapan untuk mencapai α-zo-stoadipate dan 4 lainnya untuk mengubah α-zo-dotadipato menjadi asetil coenzyme ke.
Urutan degradasi sampai α-cetoadipato adalah:
Typtophan → N-Formil quinurenine → quinurenin → 3-hydroxi quinurenine → 3-hydroxy-anttranilate → ε-semialdehyde 2-amino-3-muconcycix → ε-semialdehido α-amino muouzo Amzo.
Enzim yang mengkatalisasi reaksi ini masing -masing adalah:
Typtophan 2-3-dioxigenase, formamidase quinurenine, monooxigenase yang bergantung pada NADPH-dependen NADPH.
Setelah α-cethoadipate dihasilkan, dekarboksilasi oksidatif terbentuk GLUTERAL-COA. Ini, dengan ß-oksidasi, bentuk glutaconyl-coA yang kehilangan atom karbon bikarbonat (HCO3-), memenangkan molekul air dan berakhir sebagai crotonil-CoA.
Crotonil-CoA, juga untuk ß-oksidasi, menghasilkan asetil-CoA. Kata asetil-CoA dapat mengikuti beberapa cara, di antaranya glukoneogenesis, untuk membentuk glukosa dan siklus Krebs, untuk membentuk ATP, sebagaimana diperlukan, seperlunya.
Namun, molekul ini juga dapat diarahkan pada pembentukan tubuh keton, yang akhirnya dapat digunakan sebagai sumber energi.
Makanan yang kaya akan tryptophan
Daging merah pada umumnya, ayam dan ikan (terutama ikan biru seperti salmon dan tuna) sangat kaya akan triptofan. Susu dan turunannya, telur, terutama kuning telur, juga merupakan makanan dengan banyak kandungan triptofan.
Makanan lain yang berfungsi sebagai sumber alami asam amino ini adalah:
- Kacang -kacang seperti kacang -kacangan, almond, pistachio dan anacardos, antara lain.
- Sereal beras.
- Biji -bijian kering seperti kacang, lentil, buncis, kedelai, quinoa, dll.
- Ragi bir dan kacang segar, pisang dan pisang, nanas atau ananá, alpukat, plum, selada air, brokoli, bayam dan cokelat.
Itu dapat melayani Anda: Shark kapal selam: Sejarah, kenyataan atau fiksi?Manfaat Asupan Anda
Konsumsi typtophan benar -benar diperlukan untuk mensintesis semua protein yang memasukkannya ke dalam strukturnya dan melalui fungsinya yang berbeda memungkinkan pengatur suasana hati, tidur dan siklus berjaga -jaga dan berbagai macam proses biokimia di mana NAD berpartisipasi.
Selain efek yang diketahui pada suasana hati, serotonin (tryptophan turunan) mengintervensi dalam berbagai fungsi kognitif yang terkait dengan pembelajaran dan memori yang, oleh karena itu, juga terkait dengan tryptophan.
Ada data yang menunjukkan hubungan antara suasana hati, serotonin, dan sumbu gastrointestinal sebagai sistem pengaruh dua arah antara pusat emosi dan kognitif otak dan fungsi perifer dari saluran pencernaan.
Gunakan sebagai suplemen makanan untuk pengobatan beberapa gangguan, terutama yang terkait dengan sistem saraf pusat, telah sangat kontroversial karena transportasi kompetitifnya dengan asam amino netral, jauh lebih banyak, membuat sulit untuk mencapai peningkatan yang signifikan dan berkelanjutan dalam tryptophan setelahnya administrasi lisannya.
Terlepas dari kontroversi ini, penggunaannya telah dipostulatkan sebagai tambahan di:
- Perawatan nyeri
- Gangguan tidur
- Pengobatan depresi
- Perawatan mania
- Pengurangan nafsu makan
Gangguan Kekurangan
Eliminasi sentral atau kurangnya triptofan disertai dengan depresi, kegagalan dalam perhatian, penurunan ingatan, tidur dan gangguan kecemasan.
Pada pasien yang mengalami depresi dan dengan tren bunuh diri, perubahan konsentrasi darah dan cairan serebrospinal telah ditemukan. Selain itu, beberapa pasien dengan anoreksia saraf menunjukkan kadar triptofan serum yang rendah.
Beberapa pasien poliurik, yang kehilangan vitamin B6 dan seng, sering memiliki fobia dan kecemasan dan meningkat dengan suplemen makanan yang kaya triptofan.
Sindrom karsinoid ditandai dengan adanya tumor usus kecil yang menyebabkan diare, penyakit pembuluh darah dan bronkokonstriksi dan terkait dengan niasin dan defisit tripofan
Pelagra adalah kondisi patologis yang disertai dengan diare, demensia, dermatitis dan dapat menyebabkan kematian, ini juga diobati dengan suplemen niasin dan triptofan.
Penyakit Hartnup harus dilakukan, di antara beberapa hal, dengan cacat dalam metabolisme beberapa asam amino, termasuk triptofan.
Dalam kasus dengan defisit enzim typtophan -2,3-monoxigenase, ini adalah penyakit herediter resesif yang ditandai dengan keterbelakangan mental dan perubahan kulit tipe kulit.
Referensi
- Halvorsen, k., & Halvorsen, s. (1963). Penyakit Hartnup. Pediatri, 31(1), 29-38.
- Hood, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Panik Don. Panduan untuk menipisnya triptofan dengan provokasi kecemasan khusus gangguan. Jurnal Psikofarmakologi, 30(11), 1137-140.
- Jenkins, t. KE., Nguyen, J. C., Polglaze, k. DAN., & Bertrand, P. P. (2016). Pengaruh tryptophan dan serotonin pada suasana hati dan kognisi dengan kemungkinan peran poros usus-boin. Nutrisi, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. KE., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Efek anxiolytic dari penipisan triptofan akut pada anoreksia nervosa. Jurnal Internasional Gangguan Makan, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, v. (2009). Biokimia Illustrated Harper. 28 (P. 588). New York: McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip -prinsip biokimia lehninger. Macmillan.

