Struktur Sulfur Trioksida (SO3), Properti, Risiko, Penggunaan
- 2869
- 260
- Frederick Pfeffer
Dia Sulfur trioksida Ini adalah senyawa anorganik yang dibentuk oleh penyatuan atom belerang dan 3 atom oksigen (O). Formula molekulnya begitu3. Pada suhu kamar, SO3 Itu adalah cairan yang mengeluarkan gas di udara.
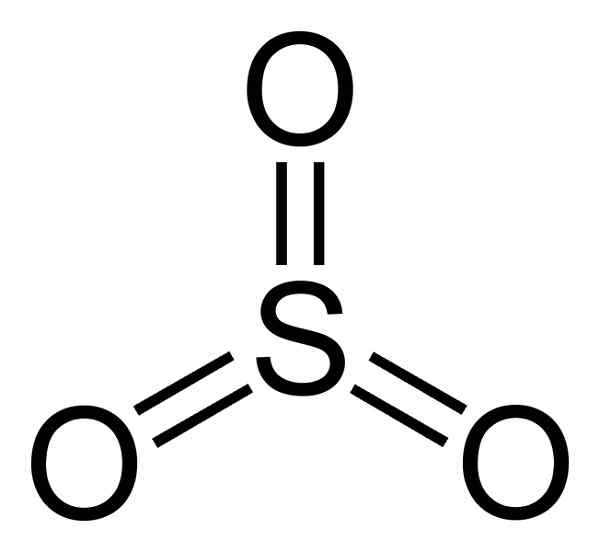
Struktur SO3 Gas datar dan simetris. Tiga oksigen terletak secara adil di sekitar belerang. SO3 Bereaksi dengan keras dengan air. Reaksinya eksotermik, yang berarti bahwa panas dihasilkan, dengan kata lain, banyak yang dipanaskan.
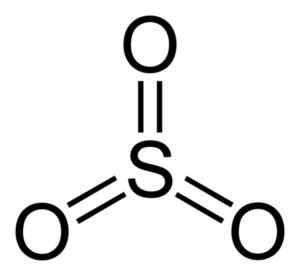 Molekul sulfur trioksida jadi3. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Molekul sulfur trioksida jadi3. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Saat begitu3 Cairan dingin, menjadi padatan yang dapat memiliki tiga jenis struktur: alpha, beta dan gamma. Yang paling stabil adalah alfa, dalam bentuk lapisan bersama satu sama lain yang merupakan jaringan.
Gas sulfur trioksida digunakan untuk menyiapkan asam sulfat merokok, juga disebut minyak, karena minyak atau zat berminyak kemiripan. Lain dari aplikasi pentingnya adalah dalam sulfonasi senyawa organik, yaitu penambahan kelompok -jadi3- kepada ini. Dengan demikian, bahan kimia yang berguna dapat disiapkan seperti deterjen, pewarna, pestisida, di antara banyak lainnya.
SO3 Ini sangat berbahaya, dapat menyebabkan luka bakar, mata, dan kerusakan kulit yang serius. Juga tidak boleh dihirup atau dicerna karena dapat menyebabkan kematian oleh luka bakar internal, di mulut, kerongkongan, lambung, dll.
Untuk alasan ini, itu harus dimanipulasi dengan sangat hati -hati. Anda tidak boleh menghubungi air atau bahan yang mudah terbakar seperti kayu, kertas, kain, dll., Nah, api bisa diproduksi. Juga tidak boleh dibuang atau selokan karena bahaya ledakan.
SO3 Gas yang dihasilkan dalam proses industri tidak boleh dilepaskan ke lingkungan, karena itu adalah salah satu dari mereka yang bertanggung jawab atas hujan asam yang telah merusak ekstensi besar hutan di dunia.
[TOC]
Struktur
Molekul sulfur trioksida jadi3 Dalam keadaan gas itu memiliki struktur segitiga datar.
Ini berarti bahwa baik sulfur dan tiga oksigen ditemukan di bidang yang sama. Selain itu, distribusi oksigen dan semua elektron bersifat simetris.
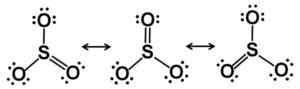 Lewis Resonance Starcutures. Elektron didistribusikan secara adil di SO3. Penulis: Marilú Stea.
Lewis Resonance Starcutures. Elektron didistribusikan secara adil di SO3. Penulis: Marilú Stea. Dalam keadaan solid tiga jenis struktur yang diketahui3: Alfa (α-so3), beta (β-so3) dan gamma (γ-so3).
Bentuk gamma γ-jadi3 mengandung pemangkas siklik, yaitu, tiga unit dari demikian3 bersama -sama membentuk molekul berbentuk siklis atau cincin.
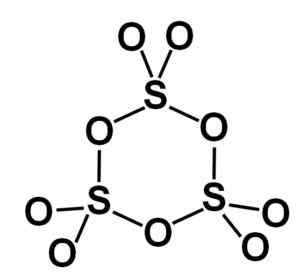 Molekul cincin gamma tipe sulfur sulfur sulfur. Penulis: Marilú Stea.
Molekul cincin gamma tipe sulfur sulfur sulfur. Penulis: Marilú Stea. Fase beta β-so3 Ini memiliki rantai heliks yang tak terbatas dari komposisi tetrahedra4 bersatu satu sama lain.
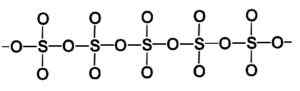 Struktur beta tipe sulfur trioksida solid. Penulis: Marilú Stea.
Struktur beta tipe sulfur trioksida solid. Penulis: Marilú Stea. Cara paling stabil adalah alfa α-so3, Mirip dengan beta tetapi dengan struktur lapisan, dengan rantai United membentuk jaringan.
Tata nama
-Sulfur trioksida
-Anhidrida sulfur
-Oksida sulfat
-Sw3 Gamma, γ-SO3
-Sw3 beta, β-so3
-Sw3 Alfa, α-SO3
Properti fisik
Keadaan fisik
Pada suhu kamar (sekitar 25 ºC) dan tekanan atmosfer, SO3 Itu adalah cairan tidak berwarna yang memancarkan asap di udara.
Saat begitu3 Cairan murni pada 25 ºC adalah campuran dari SO3 monomerik (molekul tunggal) dan trimerik (3 molekul terikat) dari Formula S3SALAH SATU9, juga disebut demikian3 Gamma γ-SO3.
Dapat melayani Anda: Skala Rankine: Apa itu, konversi, contohSaat menurunkan suhu, jika begitu3 Itu murni saat mencapai 16,86 ºC, itu memperkuat atau membekukan γ-SO3, juga disebut "begitu es3".
Jika mengandung sejumlah kecil kelembaban (bahkan jejak atau jumlah yang sangat kecil) SO3 Polimerisasi beta β-so3 yang membentuk kristal dengan kecerahan halus.
Kemudian lebih banyak serikat dibentuk dengan menghasilkan struktur α-SO3, yang merupakan padatan kristal dalam bentuk jarum yang menyerupai asbes atau asbes.
Saat alfa dan beta melt menghasilkan gamma.
Berat molekul
80,07 g/mol
Titik lebur
Sw3 Gamma = 16,86 ºC
Tiga poin
Ini adalah suhu di mana tiga keadaan fisik hadir: padat, cair dan gas. Dalam bentuk alpha, titik tiga pada 62,2 ºC dan dalam beta berada pada 32,5 ºC.
Dengan memanaskan bentuk alfa, ini memiliki kecenderungan yang lebih besar untuk mensublimasikan daripada meleleh. Sublimimar berarti bergerak dari keadaan padat ke soda secara langsung, tanpa melalui keadaan cair.
Titik didih
Semua bentuk SO3 Rebus di 44,8 ºC.
Kepadatan
SO3 Cairan (gamma) memiliki kepadatan 1.9225 g/cm3 pada 20 ºC.
SO3 Gas memiliki kepadatan 2,76 relatif terhadap udara (udara = 1), menunjukkan bahwa itu lebih berat dari udara.
Tekanan uap
Sw3 Alfa = 73 mm Hg pada 25 ºC
Sw3 Beta = 344 mm Hg pada 25 ° C
Sw3 Gamma = 433 mm Hg pada 25 ºC
Ini berarti bahwa bentuk gamma cenderung lebih mudah menguap daripada beta dan ini bahwa alfa.
Stabilitas
Bentuk alfa adalah struktur yang paling stabil, yang lain adalah metastable, yaitu, mereka kurang stabil.
Sifat kimia
SO3 bereaksi dengan penuh semangat dengan air untuk memberikan asam sulfat H2Sw4. Saat bereaksi ada sangat panas sehingga uap air dengan cepat terlepas dari campuran.
Terkena udara itu3 menyerap kelembaban dengan cepat, memancarkan uap padat.
Ini adalah agen dehidrasi yang sangat kuat, ini berarti menghilangkan air dengan mudah dari bahan lain.
Belerang dari SO3 Ini memiliki afinitas untuk elektron bebas (yaitu elektron yang tidak berada dalam hubungan antara dua atom) sehingga cenderung membentuk kompleks dengan senyawa yang memilikinya seperti piridin, trimetilamin atau dioksan.
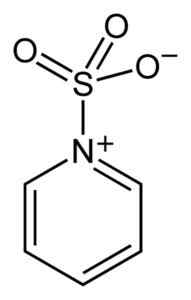 Kompleks antara sulfur trioksida dan piridin. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Kompleks antara sulfur trioksida dan piridin. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Dengan membentuk kompleks, belerang mengambil "meminjam" elektron senyawa lain untuk memuaskan kekurangan mereka. Sulfur trioksida masih tersedia di kompleks ini, yang digunakan dalam reaksi kimia untuk memberikannya3.
Ini adalah reagen sulfonan yang kuat dari senyawa organik, yang berarti bahwa ia berfungsi dengan mudah menambahkan grup -jadi3- Ke molekul.
Itu bereaksi dengan mudah dengan oksida dari banyak logam untuk memberikan sulfat logam ini.
Ini korosif terhadap logam, jaringan hewan dan tanaman.
SO3 Ini adalah bahan yang sulit untuk ditangani karena beberapa alasan: (1) titik didihnya relatif rendah, (2) memiliki kecenderungan untuk membentuk polimer padat pada suhu kurang dari 30 ºC dan (3) memiliki reaktivitas tinggi terhadap hampir semua zat organik Dan airnya.
Dapat melayani Anda: padatan amorf: struktur, sifat, contohItu dapat polimerisasi secara eksplosif jika tidak mengandung penstabil dan ada kelembaban. Sebagai penstabil, dimethylsulfate atau boron oksida digunakan.
Memperoleh
Diperoleh dengan reaksi pada 400 ºC antara sulfur dioksida2 dan oksigen molekuler atau2. Namun, reaksinya sangat lambat dan katalis diperlukan untuk meningkatkan kecepatan ini.
2 Jadi2 + SALAH SATU2 ⇔ 2 Jadi3
Di antara senyawa yang mempercepat reaksi ini adalah pt logam platino, vanadium pentoxide v2SALAH SATU5, Oksida besi2SALAH SATU3 dan oksida nitrat.
Aplikasi
Dalam persiapan minyak
Salah satu aplikasi utamanya terdiri dalam persiapan minyak atau asam sulfat asap, disebut karena memancarkan uap yang terlihat ke mata telanjang. Untuk mendapatkannya, SO diserap3 Pada asam sulfat pekat H2Sw4.
 Pu -sulfuric oleum atau merokok. Anda dapat melihat asap putih keluar dari botol. W. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Pu -sulfuric oleum atau merokok. Anda dapat melihat asap putih keluar dari botol. W. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Ini dilakukan di menara stainless steel khusus di mana asam sulfat pekat (yang cair)3 Gaseous sedang naik.
Cairan dan gas bersentuhan dan bergabung, membentuk oleum yang merupakan cairan penampilan berminyak. Ini memiliki campuran h2Sw4 Dan sebagainya3, tetapi juga memiliki molekul asam disulfuriik2S2SALAH SATU7 dan trisulfuric h2S3SALAH SATU10.
Dalam reaksi sulfonasi kimia
Sulfonasi adalah proses utama dalam aplikasi industri skala besar untuk pembuatan deterjen, surfaktan, pewarna, pestisida dan produk farmasi.
SO3 Ini berfungsi sebagai zat sulfonan untuk menyiapkan minyak sulfon dan deterjen sulfon alkil, di antara banyak senyawa lainnya. Di bawah ini adalah reaksi sulfonasi dari senyawa aromatik:
Arh + jadi3 → Arso3H
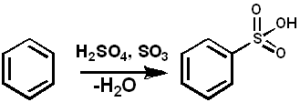 Sulfonasi benzena dengan begitu3. PEDRO8410 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Sulfonasi benzena dengan begitu3. PEDRO8410 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Untuk reaksi sulfonasi, oleum atau lebih dapat digunakan3 dalam bentuk kompleksnya dengan piridin atau trimethylamine, antara lain.
Dalam ekstraksi logam
Gas s3 Itu telah digunakan dalam pengobatan mineral. Oksida logam sederhana bisa menjadi sulfat yang jauh lebih larut saat merawatnya dengan demikian3 pada suhu yang relatif rendah.
Mineral belerang seperti pirit (besi sulfida), traktat3 Memungkinkan logam ini dengan mudah dan dengan biaya rendah.
Besi, nikel dan tembaga sulfida bereaksi dengan gas begitu3 Bahkan pada suhu kamar, membentuk masing -masing sulfat, yang sangat larut dan dapat dikenakan proses lain untuk mendapatkan logam murni.
Dalam beberapa kegunaan
SO3 Itu berfungsi untuk menyiapkan asam klorosulfuri juga disebut asam klorosulfonat HSO3Cl.
Sulfur trioksida adalah oksidan yang sangat kuat dan digunakan dalam pembuatan eksplosif.
Risiko
Untuk kesehatan
SO3 Ini adalah senyawa yang sangat beracun dari semua rute, yaitu, inhalasi, konsumsi dan kontak kulit.
Irrita dan korosi selaput lendir. Menyebabkan kulit dan mata. Uapnya sangat beracun saat dihirup. Luka bakar internal diproduksi, kesulitan bernapas, nyeri dada dan edema paru.
Dapat melayani Anda: butanone: struktur, sifat dan penggunaan Sulfur trioksida SO3 sangat korosif dan berbahaya. Penulis: Openicons. Sumber: Pixabay.
Sulfur trioksida SO3 sangat korosif dan berbahaya. Penulis: Openicons. Sumber: Pixabay. Itu beracun. Konsumsi menghasilkan luka bakar, kerongkongan, dan lambung yang parah. Selain itu, diduga itu adalah karsinogen.
Api atau ledakan
Ini mewakili bahaya kebakaran saat bersentuhan dengan bahan organik seperti kayu, serat, kertas, minyak, kapas, antara lain, terutama jika mereka basah.
Ada juga risiko jika Anda bersentuhan dengan pangkalan atau agen pereduksi. Ini dikombinasikan dengan air secara eksplosif, membentuk asam sulfat.
Kontak dengan logam dapat menghasilkan gas hidrogen h2 yang sangat mudah terbakar.
Itu harus dihindari di kapal kaca untuk mencegah kemungkinan pecahnya wadah.
Dampak lingkungan
SO3 Itu dianggap sebagai salah satu polutan terbesar yang ada di atmosfer bumi. Hal ini disebabkan oleh perannya dalam pembentukan aerosol dan kontribusinya terhadap hujan asam (karena pembentukan asam sulfat H2Sw4).
 Hutan rusak akibat hujan asam di Republik Ceko. Lovecz [domain publik]. Sumber: Wikimedia Commons.
Hutan rusak akibat hujan asam di Republik Ceko. Lovecz [domain publik]. Sumber: Wikimedia Commons. SO3 Itu terbentuk di atmosfer karena oksidasi sulfur dioksida2. Saat SO terbentuk3 Ini bereaksi dengan cepat dengan air untuk membentuk asam sulfat h2Sw4. Menurut penelitian terbaru, ada mekanisme transformasi SOS lainnya3 Di atmosfer, tetapi karena jumlah besar air yang ada dalam yang satu ini, SO masih dipertimbangkan3 Terutama dikonversi ke h2Sw4.
SO3 Gas atau limbah gas industri yang mengandung tidak boleh diunduh ke atmosfer karena kontaminan berbahaya. Ini adalah gas yang sangat reaktif dan, seperti yang telah dikatakan di atas, di hadapan kelembaban udara3 Itu menjadi asam sulfat h2Sw4. Oleh karena itu, di udara SO3 bertahan dalam bentuk asam sulfat yang membentuk tetesan kecil atau aerosol.
Jika tetesan asam sulfat memasuki saluran pernapasan manusia atau hewan, mereka tumbuh dengan cepat karena kelembaban yang ada di sana, sehingga mereka memiliki kemungkinan menembus paru -paru. Salah satu mekanisme dengan kabut asam h2Sw4 (itu sangat3) Ini dapat menghasilkan toksisitas yang kuat adalah karena pH ekstraseluler dan intraseluler dari organisme hidup (tanaman, hewan dan manusia) berubah perubahan).
Menurut beberapa peneliti, jadi kabut3 Itu adalah penyebab peningkatan pendik di daerah Jepang. Kabut begitu3 Ini memiliki efek yang sangat korosif pada logam, sehingga struktur logam yang dibangun oleh manusia seperti beberapa jembatan dan konstruksi dapat sangat terpengaruh.
SO3 Cairan tidak boleh dibuang dalam drainase air kotor atau selokan. Jika dituangkan ke dalam selokan, Anda dapat membuat bahaya api atau ledakan. Jika ditumpahkan secara tidak sengaja, aliran air tidak boleh diarahkan ke produk. Seharusnya tidak pernah diserap dalam serbuk gergaji atau bahan bakar penyerap lainnya, karena dapat menghasilkan kebakaran.
Itu harus diserap dalam pasir kering, tanah kering atau penyerap inert yang benar -benar kering lainnya. SO3 Itu tidak boleh dituangkan ke dalam lingkungan dan tidak boleh berhubungan dengan ini. Itu harus dijaga jauh dari sumber air karena dengan ini menghasilkan asam sulfat yang berbahaya bagi organisme akuatik dan tanah.
Referensi
- Sarkar, s. et al. (2019). Pengaruh amonia dan air pada nasib sulfur trioksida di troposfer: penelitian teoritis asam sulfamat dan jalur pembentukan asam sulfat. J phys chem a.2019; 123 (14): 3131-3141. NCBI pulih.Nlm.Nih.Pemerintah.
- Muller, t.L. (2006). Asam sulfat dan sulfur trioksida. Ensiklopedia Kirk-Othmer Teknologi Kimia. Volume 23. Diperoleh dari perpustakaan online.Wiley.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sulfur trioksida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kikuchi, r. (2001). Manajemen Lingkungan Imisi Sulfur Trioksida: Dampak SO3 Tentang kesehatan manusia. Manajemen Lingkungan (2001) 27: 837. Tautan pulih.Peloncat.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Ismail, m.yo. (1979). Ekstraksi logam dari sulfida menggunakan sulfur trioksida dalam lapisan terfluidisasi. J. Chem. Tech. Bioteknol. 1979, 29, 361-366. Diperoleh dari perpustakaan online.Wiley.com.
- « Geografi Lago Malawi, Geologi, Pentingnya, Fauna, Rios
- Struktur Sodium Cyanide (NACN), Properti, Risiko, Penggunaan »

