Sejarah yodium, sifat, struktur, memperoleh, risiko, penggunaan

- 2345
- 340
- Irvin Reichel
Dia yodium Ini adalah elemen non -metalik reaktif yang dimiliki kelompok 17 dari tabel periodik (halogen) dan diwakili oleh simbol kimia i. Intinya itu adalah elemen yang terkenal di tingkat populer, dari air beryodium, hingga hormon tirosin.
Dalam keadaan padat yodium berwarna abu -abu gelap dengan kilau logam (gambar bawah), mampu menyublimkan untuk menghasilkan uap ungu yang, saat meringkas di permukaan dingin, meninggalkan residu gelap. Banyak dan menarik telah menjadi percobaan untuk menunjukkan karakteristik ini.
 Kristal yodium yang kuat. Sumber: bungee [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Kristal yodium yang kuat. Sumber: bungee [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Elemen ini diisolasi untuk pertama kalinya oleh Bernard Curtois pada tahun 1811, sambil mendapatkan senyawa yang berfungsi sebagai bahan baku untuk pembuatan Saltpeter. Namun, Curtois tidak mengidentifikasi yodium sebagai elemen, prestasi yang dibagikan oleh Joseph Gay-Lussac dan Humphry Davy. Gay-Lussac mengidentifikasi elemen itu sebagai "iode", sebuah istilah yang berasal dari kata Yunani "ioides" yang dengannya warna ungu ditunjuk.
Yodium dasar, seperti halogen lainnya, adalah molekul diatomik, yang dibentuk oleh dua atom yodium yang disatukan oleh ikatan kovalen. Interaksi van der Waals antara molekul yodium adalah yang terkuat di antara halogen. Ini menjelaskan mengapa yodium adalah halogen dengan titik meleleh dan mendidih tertinggi. Selain itu, ini adalah reagen halogen yang paling sedikit, dan yang dengan lebih sedikit elektronegativitas.
Yodium adalah elemen penting yang perlu dicerna, karena itu diperlukan untuk pertumbuhan tubuh; perkembangan otak dan mental; Metabolisme secara umum, dll., merekomendasikan asupan harian 110 μg/hari.
Kekurangan yodium dalam keadaan janin seseorang dikaitkan dengan penampilan cretinisme, suatu kondisi yang ditandai dengan memperlambat pertumbuhan tubuh; serta perkembangan mental dan intelektual yang tidak mencukupi, strabismus, dll.
Sementara itu, kekurangan yodium pada usia berapa pun dikaitkan dengan penampilan gondok, ditandai dengan hipertrofi tiroid. Goiter adalah penyakit endemik, karena terbatas pada wilayah geografis tertentu dengan karakteristik makanan sendiri.
[TOC]
Sejarah
Penemuan
Yodium itu ditemukan oleh ahli kimia Prancis Bernard Curtois, pada tahun 1811, saat bekerja dengan ayahnya dalam produksi salitre, yang membutuhkannya dari natrium karbonat.
Senyawa ini diisolasi dari rumput laut yang dikumpulkan di pantai Normandia dan Brittany. Untuk tujuan ini, ganggang terbakar dan abu dicuci dengan air, menghancurkan limbah yang dihasilkan dengan penambahan asam sulfat.
Pada satu kesempatan, mungkin karena kesalahan yang kebetulan, Curtois menambahkan kelebihan asam sulfat dan uap ungu terbentuk yang mengkristal pada permukaan dingin, diendapkan sebagai kristal gelap. Curtois curiga dia berada di hadapan unsur baru dan memanggilnya "zat x".
Curtois menemukan bahwa zat ini ketika dicampur dengan amonia membentuk padatan coklat (nitrogen triacuro) yang mengeksploitasi kontak minimal.
Namun, Curtois memiliki keterbatasan untuk melanjutkan penelitiannya dan memutuskan untuk memberikan tanda-tanda zatnya kepada Charles Desormes, Nicolas Clément, Joseph Gay-Lussac dan André-Marie Ampère, untuk mendapatkan kolaborasinya.
Munculnya Nama
Pada bulan November 1813, Desormes dan Clément mengumumkan penemuan Curtois. Pada bulan Desember pada tahun yang sama, Gay-Lussac mengatakan bahwa zat baru itu bisa menjadi elemen baru, menunjukkan nama "iode" dari kata Yunani "ioides", yang ditunjuk untuk violet.
Sir Humphry Davy, yang menerima sebagian dari sampel yang dikirim ke Ampère oleh Curtois, melakukan percobaan dengan sampel dan memperhatikan kesamaan dengan klorin. Pada bulan Desember 1813, Royal Society of London berpartisipasi tentang identifikasi elemen baru.
Meskipun argumen antara Gay-Lussac dan Davy tentang identifikasi yodium muncul, keduanya mengakui bahwa Curtois adalah orang pertama yang mengisolasinya. Pada 1839 final Curtois.
Penggunaan historis
Pada tahun 1839, Louis Daguerre memberi yodium penggunaan komersial pertama, dengan penemuan metode untuk menghasilkan gambar fotografi yang disebut daguerreotypes, dalam lembaran logam tipis.
Pada tahun 1905, ahli patologi Amerika David Marine, menyelidiki kekurangan yodium pada penyakit tertentu dan merekomendasikan asupannya.
Sifat fisik dan kimia
Penampilan
 Sublimasi kristal yodium. Sumber: Ershova Elizaveta [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Sublimasi kristal yodium. Sumber: Ershova Elizaveta [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Kilau logam abu -abu gelap. Ketika itu menyublimkan uapnya, mereka adalah warna ungu (gambar superior).
Berat atom standar
126.904 u
Nomor Atom (Z)
53
Titik lebur
113.7 ºC
Titik didih
184.3 ºC
Kepadatan
Suhu sekitar: 4.933 g/cm3
Kelarutan
Di dalam air itu larut menyebabkan larutan coklat konsentrasi 0,03% hingga 20 ºC.
Kelarutan ini meningkat pesat jika ada ion iodida yang sebelumnya dilarutkan, sebagai keseimbangan antara I ditetapkan- dan saya2 Untuk membentuk spesies anionik i3-, yang terpecahkan lebih baik dari yodium.
Dalam pelarut organik seperti kloroform, karbon tetraklorida dan karbon disulfida, yodium larut memberikan warna ungu. Ini juga larut dalam senyawa nitrogen, seperti piridin, quinoline dan amonia, untuk membentuk larutan cokelat, lagi.
Perbedaan warna terletak pada kenyataan bahwa yodium dilarutkan sebagai molekul terlarut i2, atau sebagai kompleks transfer beban; Yang terakhir muncul saat berurusan.
Dapat melayani Anda: natrium sulfida (na2s)Bau
Hektar, menjengkelkan dan khas. Ambang Bau: 90 mg/m3 dan ambang bau menjengkelkan: 20 mg/m3.
Koefisien Partisi Octanol/Air
Log p = 2.49
Penguraian
Ketika dia dipanaskan untuk dekomposisi, dia memancarkan asap hidrogen iodida dan beberapa senyawa iodida.
Zat yang lengket dan kental
2.27 cp pada 116 ºC
Tiga poin
386.65 K dan 121 kPa
Titik kritis
819 K dan 11,7 MPa
Panas fusi
15.52 kJ/mol
Panas penguapan
41.57 kJ/mol
Kapasitas kalori molar
54.44 J/(mol · k)
Tekanan uap
Yodium memiliki tekanan uap sedang dan ketika wadah yang mengandung dibuka, perlahan -lahan disublimasikan menjadi uap ungu, mengiritasi mata, hidung dan tenggorokan.
Angka oksidasi
Angka oksidasi untuk yodium adalah: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) dan +7 (i7+). Dalam semua garam iodida, seperti halnya ki, yodium memenuhi jumlah oksidasi -1, karena kami memiliki anion i-.
Yodium memperoleh bilangan oksidasi positif ketika dikombinasikan dengan elemen elektronegatif yang lebih besar daripada dia; Misalnya, dalam oksida mereka (i2SALAH SATU5 dan saya4SALAH SATU9) atau senyawa intehalogenasi (I-F, I-CL dan I-BR).
Elektronegativitas
2.66 pada skala Pauling
Energi ionisasi
Pertama: 1.008.4 kJ/mol
Kedua: 1.845 kJ/mol
Ketiga: 3.180 kJ/mol
Konduktivitas termal
0.449 w/(m · k)
Resistivitas listrik
1.39 · 107 Ω · m hingga 0 ºC
Urutan magnetik
Diamagnetik
Reaktivitas
Yodium dikombinasikan dengan sebagian besar logam untuk membentuk iodida, dan juga dengan elemen non -metalik seperti fosfor dan halogen lainnya. Ion iodida adalah zat pereduksi yang kuat, yang secara spontan melepaskan elektron. Oksidasi iodida menghasilkan pewarna yodium kecoklatan.
Yodium, sebaliknya iodida, adalah agen pengoksidasi yang lemah; lebih lemah dari bromin, klorin dan fluoride.
Yodium dengan bilangan oksidasi +1 dapat dikombinasikan dengan halogen lain dengan bilangan oksidasi -1, untuk berasal halida yodium; Misalnya: yodium bromida. Ini juga dikombinasikan dengan hidrogen untuk menyebabkan hidrogen iodida, yang setelah larut dalam air disebut asam iarhydic.
Asam yodhorc adalah asam yang sangat kuat yang mampu membentuk iodida dengan reaksi dengan logam atau oksida, hidroksida dan karbonatnya. Yodium memiliki keadaan oksidasi +5 dalam asam yodium (HIO3), yang didehidrasi untuk menghasilkan yodium pentoksida (i2SALAH SATU5).
Struktur dan konfigurasi elektronik
- Atom yodium dan tautannya
 Molekul diatomik yodium. Sumber: Benjah-BMM27 via Wikipedia.
Molekul diatomik yodium. Sumber: Benjah-BMM27 via Wikipedia. Yodium dalam keadaan basal terdiri dari atom yang memiliki tujuh elektron Valencia, hanya satu yang mampu menyelesaikan oktet dan menjadi isolektronik dengan gas xenon mulia. Ketujuh elektron ini diatur dalam orbital 5s dan 5p mereka sesuai dengan konfigurasi elektroniknya:
[Kr] 4d10 5S2 5 p5
Oleh karena itu, atom saya menunjukkan kecenderungan kuat untuk menghubungkan secara kovalen sehingga masing -masing secara individual memiliki delapan elektron di lapisan terluarnya. Jadi, dua atom I mendekati dan membentuk tautan I-I, yang mendefinisikan molekul diatomik i2 (gambar superior); Unit molekuler yodium dalam tiga keadaan fisiknya dalam kondisi normal.
Pada gambar molekul saya diamati2 diwakili oleh model pengisian ruang. Tidak hanya molekul diatomik, tetapi juga homonuklear dan apolar; Jadi interaksi antar molekulnya (i2 - yo2) Mereka diatur oleh pasukan dispersi London, yang berbanding lurus dengan massa molekul dan ukuran atom mereka.
Tautan I-I ini, bagaimanapun, lebih lemah dibandingkan dengan halogen lainnya (F-F, CL-CL dan BR-BR). Secara teori ini karena tumpang tindih yang buruk dari spo -nya3.
- Kristal
Massa molekul i2 Ini memungkinkan kekuatan dispersifnya menjadi cukup arah dan kuat untuk membangun kaca ortorombik pada tekanan sekitar. Kandungan elektronnya yang tinggi membuat cahaya mempromosikan simfin transisi energi, yang menghasilkan kristal yodium.
Namun, ketika yodium mensublimasi uapnya menunjukkan warna ungu. Ini sudah menunjukkan transisi yang lebih spesifik dalam orbital molekul i2 (Mereka yang memiliki energi atau antienlace yang lebih besar).
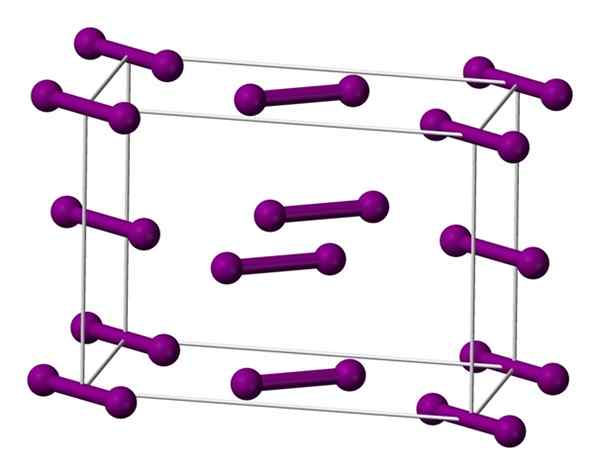 Sel ortorombik kesatuan berpusat di pangkalan untuk kristal yodium. Sumber: Benjah-BMM27 [Domain Publik].
Sel ortorombik kesatuan berpusat di pangkalan untuk kristal yodium. Sumber: Benjah-BMM27 [Domain Publik]. Molekul yang saya tunjukkan di atas2, diwakili oleh model bola dan batang, dipesan di dalam sel ortorombik.
Dapat diamati bahwa ada dua lapisan: yang dari bawah dengan lima molekul, dan medium dengan empat. Perhatikan bahwa molekul yodium terletak di dasar sel. Kristal dibangun secara berkala lapisan -lapisan ini dalam tiga dimensi.
Berlangsung ke arah yang sejajar dengan tautan I-I, ditemukan bahwa orbital yodium tumpang tindih untuk menghasilkan band mengemudi, yang kembali ke elemen ini semikonduktor; Namun, kemampuannya untuk menghilang jika terjadi arah jika arah yang tegak lurus terhadap lapisan.
Jarak tautan
Tautan I-I tampaknya telah ditunda; Dan sebenarnya itu, karena panjang tautannya meningkat dari 266 pm (keadaan gas), 272 pm (solid state).
Ini mungkin karena fakta bahwa dalam gas molekul i2 Mereka sangat jauh, kekuatan antarmolekul mereka hampir dapat diabaikan; Sementara di padatan, kekuatan-kekuatan ini (I-i-i) menjadi nyata, menarik atom yodium dari dua molekul tetangga terhadap diri mereka sendiri dan sesuai dengan jarak antar molekul (atau interatomik, jika tidak terlihat).
Itu dapat melayani Anda: hubungan kimia dengan ilmu lainKemudian, ketika kaca yodium sublimal, ikatan I-I berkontraksi dalam fase gas, karena molekul tetangga tidak lagi memberikan gaya tarik yang sama (dispersif) di sekitarnya. Dan juga, secara logis, jarak saya2 - yo2 meningkat.
- Fase
Disebutkan di atas bahwa tautan I-I lebih lemah dibandingkan dengan halogen lainnya. Dalam fase gas pada suhu 575 ºC, 1% dari molekul i2 Mereka hancur menjadi individu dan atom. Ada begitu banyak energi termal yang hanya dua dan kembali yang dipisahkan, dan seterusnya.
Demikian pula, pemecahan tautan ini dapat terjadi jika tekanan besar pada kristal yodium diterapkan. Saat mengompresnya terlalu banyak (di bawah tekanan ratusan ribu kali lebih tinggi dari atmosfer), molekul i2 Mereka disusun kembali sebagai fase I monoatomik, dan kemudian dikatakan bahwa yodium menunjukkan karakteristik logam.
Namun, ada fase kristal lainnya, seperti: ortrome yang berpusat pada tubuh.
Dimana itu dan dapatkan
Yodium memiliki proporsi berat, dalam kaitannya dengan kerak bumi, 0,46 ppm, menempati tempat 61 yang berlimpah di dalamnya. Mineral yoduro langka, dan endapan yodium yang dapat dieksploitasi secara komersial adalah yodatos.
Mineral yodium menemukan di batuan beku dengan konsentrasi 0,02 mg/kg pada 1,2 mg/kg, dan pada batuan magmatik dengan konsentrasi 0,02 mg pada 1,9 mg/kg. Itu juga dapat ditemukan di kimmeridge lutita, dengan konsentrasi berat 17 mg/kg.
Selain itu, mineral yodium ditemukan pada batuan fosfat dengan konsentrasi berkisar antara 0,8 dan 130 mg/kg. Air laut memiliki konsentrasi yodium yang bervariasi dari 0,1 hingga 18 μg/L. Alga, spons dan tiram laut sebelumnya adalah sumber utama yodium.
Namun, bagaimanapun, sumber utamanya adalah caliche, endapan natrium nitrat di gurun Atacama (Chili), dan Salmuela, terutama dari ladang gas Jepang di Minami Kanto, timur Tokyo, dan Cekungan Lapangan Gas Anadarko di Oklahoma (AS (USA, USA ).
Caliche
Yodium diekstraksi dari iodinus caliche dan diobati dengan natrium bisulfit untuk menguranginya menjadi iodida. Kemudian, solusinya bereaksi dengan Yodato yang baru diekstraksi untuk memfasilitasi penyaringannya. Caliche adalah sumber utama yodium di abad ke -19 dan awal abad ke -20.
Air garam
Setelah pemurniannya, air garam diobati dengan asam sulfat, yang menghasilkan iodida.
Larutan iodida ini kemudian bereaksi dengan klorin untuk menghasilkan larutan yodium encer, yang menguap dengan menggunakan arus udara yang menyimpang ke menara penyerap sulfur dioksida, menghasilkan reaksi berikut:
yo2 + 2 h2Atau +jadi2 => 2 hi +h2Sw4
Selanjutnya, gas hidrogen iodida bereaksi dengan klorin untuk melepaskan yodium dalam keadaan gas:
2 Hai +Cl2 => I2 + 2 HCl
Dan akhirnya, filter yodium, dimurnikan dan pengemasan untuk digunakan.
Kertas Biologis
- Diet yang disarankan
Yodium adalah elemen penting, karena mengintervensi berbagai fungsi dalam makhluk hidup, yang terutama dikenal pada manusia. Satu -satunya cara masuk yodium ke manusia adalah makanan yang dia konsumsi.
Diet yodium yang direkomendasikan bervariasi seiring bertambahnya usia. Jadi seorang anak laki -laki 6 bulan membutuhkan asupan 110 μg/hari; Tetapi dari usia 14, diet yang direkomendasikan adalah 150 μg/hari. Selain itu, dicatat bahwa asupan yodium tidak boleh melebihi 1.100 μg/hari.
- Hormon tiroid
Tiroid Stimulating Hormone (TSH) disekresikan oleh hipofisis dan merangsang yodium dengan folikel tiroid. Yodium dibawa di dalam folikel tiroid, dikenal sebagai koloid, di mana ia berikatan dengan asam amino tirosin untuk membentuk monoyodothyrosine dan diiodothyrosine.
Di koloid folikular, monoyodirosin3). Di sisi lain, dua molekul diiodothyrosine dapat bergabung, membentuk tetrarydotyron (t4). T3 dan T4 Mereka adalah hormon tiroid yang disebut.
Hormon t3 dan T4 Mereka disekresikan ke plasma di mana mereka mengikat protein plasma; Di antaranya protein konveyor hormon tiroid (TBG). Kebanyakan hormon tiroid diangkut dalam plasma sebagai t4.
Namun, bentuk aktif hormon tiroid adalah T3, jadi t4 Di "organ putih" hormon tiroid, pengalaman dan berubah menjadi t3 Untuk melakukan tindakan hormonal Anda.
Efek
Efek dari aksi hormon tiroid berganda, mampu menunjukkan yang berikut: Peningkatan metabolisme dan sintesis protein; promosi pertumbuhan tubuh dan perkembangan otak; Peningkatan tekanan darah dan detak jantung, dll.
- Kekurangan
Kekurangan yodium dan, oleh karena itu, hormon tiroid, yang dikenal sebagai hipotiroidisme, memiliki banyak konsekuensi yang dipengaruhi oleh usia orang tersebut.
Jika kekurangan yodium terjadi selama keadaan janin seseorang, konsekuensi yang paling relevan adalah kreatinisme. Kondisi ini ditandai dengan tanda -tanda seperti penurunan fungsi mental, keterlambatan dalam perkembangan fisik, strudisme dan pematangan seksual yang terlambat.
Dapat melayani Anda: tembaga: sejarah, sifat, struktur, penggunaan, kertas biologisKekurangan yodium dapat menginduksi gondok, terlepas dari usia di mana kekurangan terjadi. Seorang gondok adalah perkembangan tiroid yang berlebihan, yang disebabkan oleh stimulasi kelenjar yang berlebihan oleh hormon TSH, dilepaskan dari kelenjar hipofisis sebagai konsekuensi dari kekurangan yodium.
Ukuran berlebih dari tiroid (goiter) dapat mengompres trakea, membatasi lorong udara melaluinya. Selain itu, ini dapat menyebabkan kerusakan pada saraf laring yang dapat dimiliki sebagai hasil rum.
Risiko
Keracunan akibat asupan yodium yang berlebihan dapat menyebabkan luka bakar di mulut, tenggorokan dan demam. Juga sakit perut, mual, muntah, diare, denyut nadi lemah dan koma.
Kelebihan yodium menghasilkan beberapa gejala yang diamati pada kekurangan: ada penghambatan sintesis hormon tiroid, sehingga pelepasan TSH meningkat, yang menghasilkan hipertrofi tiroid; yaitu seorang gondok.
Ada penelitian yang menunjukkan bahwa asupan yodium yang berlebihan dapat menyebabkan kanker papiler tiroid. Selain itu, asupan yodium yang berlebihan dapat berinteraksi dengan obat -obatan dengan membatasi aksinya.
Asupan yodium berlebihan dengan obat antitiroid, seperti metimazole, digunakan untuk mengobati hipertiroidisme, dapat memiliki efek aditif dan menyebabkan hipotiroidisme.
Angiotensin (ECA) mengubah inhibitor enzim, seperti Benazepril, digunakan dalam pengobatan hipertensi. Mengambil jumlah kalium iodida yang berlebihan meningkatkan risiko hiperkalemia dan hipertensi.
Aplikasi
Dokter
Yodium bertindak sebagai desinfektan kulit atau luka. Ini memiliki aksi antimikroba yang hampir snapshot, menembus mikroorganisme dan berinteraksi dengan asam amino sulfur, nukleotida dan asam lemak, yang menyebabkan kematian sel.
Ini mengerahkan tindakan antivirusnya secara fundamental pada virus tertutup, mendalilkan yang menyerang permukaan virus tertutup.
Kalium iodida dalam larutan pekat, digunakan dalam pengobatan tirotoksikosis. Ini juga digunakan untuk mengontrol efek radiasi 131Saya saat memblokir penyatuan isotop radioaktif ke tiroid.
Yodium digunakan dalam pengobatan keratitis dendritik. Untuk ini, kornea ke uap air jenuh dengan yodium terpapar, epitel kornea untuk sementara kehilangan; Tapi ada pemulihan total dalam dua atau tiga hari.
Yodium juga memiliki efek menguntungkan pada pengobatan fibrosis sinus manusia. Demikian juga, telah ditunjukkan bahwa 131Saya bisa menjadi pengobatan kanker tiroid opsional.
Reaksi dan aksi katalitik
Yodium digunakan untuk mendeteksi keberadaan pati, memberikan warna biru. Reaksi yodium dengan pati juga digunakan untuk mendeteksi keberadaan tiket palsu yang dicetak di atas kertas yang berisi pati.
Kalium (II) Tetrayodomercurate, juga dikenal sebagai reagen Nessler, digunakan dalam deteksi amonia. Demikian juga, larutan yodium basa digunakan dalam tes iodoform, untuk menunjukkan keberadaan methylcetonous.
Iodida anorganik. Pada tahap proses, tetrayoduros dari logam ini harus dibentuk.
Yodium berfungsi sebagai penstabil untuk Colfonia, minyak dan produk kayu lainnya.
Yodium digunakan sebagai katalis dalam reaksi sintesis organik dari metilasi, isomerisasi dan dehidrogenasi. Sementara itu, asam iarchloric digunakan sebagai katalis untuk produksi asam asetat dalam proses monsanto dan cativa.
Yodium bertindak sebagai katalis dalam kondensasi dan alposasi amina aromatik, serta dalam proses sulfatisasi dan sulfanasi, dan untuk produksi karet sintetis.
Fotografi dan optik
Silver Yoduro adalah komponen penting dari film fotografi tradisional. Yodium digunakan dalam pembuatan instrumen elektronik seperti prisma kaca yang unik, instrumen optik polarisasi, dan kaca yang mampu mentransmisikan sinar inframerah.
Penggunaan lainnya
Yodium digunakan dalam elaborasi pestisida, anilin dan pewarna phtaleína. Selain itu, digunakan dalam sintesis pewarna, dan merupakan agen pemadam asap. Dan akhirnya, perak iodida berfungsi sebagai inti dari kondensasi uap air di awan, untuk menyebabkan hujan.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Stuart Ira Fox. (2003). Fisiologi Manusia. Edisi pertama. Edit. McGraw-Hill Inter-American
- Wikipedia. (2019). Yodium. Diperoleh dari: di.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Struptur yodium padat yang dimodulasi selama disosiasi molekul IMS. Volume Alam 423, Halaman971-974. doi.org/10.1038/Nature01724
- Chen L. et al. (1994). Transisi fase struktural yodium pada tekanan tinggi. Institut Fisika, Akademi Sinica, Beijing. doi.org/10.1088/0256-307x/11/2/010
- Stefan Schneider & Karl Christe. (26 Agustus 2019). Yodium. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Kata. Doug Stewart. (2019). Fakta elemen yodium. Chemicool. Pulih dari: chemicool.com
- Pusat Nasional Informasi Bioteknologi. (2019). Yodium. Database pubchem. CID = 807. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Rohner, f., Zimmermann, m., Jooste, hlm., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarker Nutrisi untuk Tinjauan Pengembangan-Iodine. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- Advameg. (2019). Yodium. Kimia dijelaskan. Pulih dari: chemistry explaed.com
- Traci Pedersen. (19 April 2017). Fakta tentang yodium. Dipulihkan dari: LiveScience.com
- Megan Ware, RDN, LD. (30 Mei 2017). Semua yang perlu Anda ketahui tentang yodium. Pulih dari: MedicalNewstody.com
- Institut Kesehatan Nasional. (9 Juli 2019). Yodium. Diperoleh dari: SDG.Od.Nih.Pemerintah
- « Sejarah Kripton, Properti, Struktur, Dapatkan, Risiko, Penggunaan
- Anteseden Mary Celeste, Acara, Teori »

