Formula panas ceped, cara menghitungnya dan menyelesaikan latihan

- 1999
- 104
- Ray Thiel
Dia Panas terwalah Ini adalah transfer energi antara dua tubuh pada suhu yang berbeda. Suhu yang lebih tinggi memberikan panas pada suhunya yang lebih rendah. Apakah tubuh menghasilkan atau menyerap panas, suhunya atau kondisi fisiknya dapat bervariasi tergantung pada massa dan karakteristik bahan yang dibuatnya.
Contoh yang baik adalah dalam secangkir kopi yang mengepul. Sendok logam yang diaduk gula. Jika dibiarkan di dalam cangkir cukup waktu, sendok teh kopi dan logam akan berakhir. Beberapa panas akan diteruskan ke lingkungan, karena sistem tidak terisolasi.
 Kopi dan sendok teh menjadi keseimbangan termal untuk sementara waktu. Sumber: Pixabay.
Kopi dan sendok teh menjadi keseimbangan termal untuk sementara waktu. Sumber: Pixabay. Saat suhu dicocokkan, keseimbangan termal.
Jika tes yang sama dilakukan dengan sendok teh plastik, itu pasti akan memperhatikan bahwa itu tidak memanas secepat logam, tetapi pada akhirnya itu juga akan seimbang dengan kopi dan segala sesuatu yang mengelilinginya.
Ini karena logam memimpin panas lebih baik daripada plastik. Di sisi lain, pasti kopi memberi panas pada tingkat yang berbeda dari cokelat panas atau minuman lainnya. Kemudian, panas yang ditugaskan atau diserap oleh masing -masing objek tergantung pada bahan atau zat mana yang dibuat.
[TOC]
Apa itu dan formula
Panas selalu mengacu pada aliran atau transit energi antara satu objek dan yang lain, karena perbedaan suhu.
Itulah sebabnya ada pembicaraan tentang panas yang ditugaskan atau diserap panas, karena dengan menambahkan atau mengekstraksi panas atau energi dalam beberapa cara, dimungkinkan untuk memodifikasi suhu suatu elemen.
Biasanya disebut jumlah panas yang dihasilkan objek terpanas. Nilai ini sebanding dengan massa objek tersebut. Tubuh dengan massa besar mampu melepaskan lebih banyak panas daripada massa yang lebih rendah lainnya.
Dapat melayani Anda: Millikan Eksperimen: Prosedur, Penjelasan, PentingnyaPerbedaan suhu Δt
Faktor penting lainnya dalam perhitungan panas yang ditetapkan adalah perbedaan suhu bahwa objek yang menghasilkan pengalaman panas. Itu dilambangkan sebagai ΔT Dan itu dihitung seperti ini:
Δt = tF - Tsalah satu
Akhirnya, jumlah panas yang ditugaskan juga tergantung pada sifat dan karakteristik objek, yang dirangkum secara kuantitatif dalam konstanta yang disebut Panas panas spesifik, dilambangkan sebagai C.
Jadi akhirnya ekspresi untuk panas yang ditugaskan adalah sebagai berikut:
QMelesat = - m.C.ΔT
Hasilnya dilambangkan dengan tanda negatif.
Panas spesifik dan kapasitas panas suatu zat
Panas spesifik adalah jumlah panas yang diperlukan untuk menaikkan suhu 1 g zat dengan 1 ° C. Itu adalah sifat intrinsik dari material. Unit -unitnya dalam sistem internasional adalah: joule/kg . K (joule antara kilogram x suhu dalam derajat kelvin).
Kapasitas panas C adalah konsep yang terkait, tetapi sedikit berbeda, karena massa objek mengintervensi. Kapasitas panas didefinisikan sebagai berikut:
C = mc
Unit -unitnya di S.yo. Mereka joule/k. Sehingga panas ceded juga dapat diekspresikan secara setara sebagai:
Q = -C. ΔT
Cara menghitungnya?
Untuk menghitung panas yang ditetapkan oleh suatu objek, diperlukan untuk mengetahui hal -hal berikut:
- Panas spesifik zat yang memberi panas.
- Massa zat tersebut
- Suhu akhir untuk mendapatkan
Nilai panas spesifik untuk banyak bahan telah ditentukan secara eksperimental dan tersedia dalam tabel.
Kalorimetri
Sekarang, jika nilai ini tidak diketahui, dimungkinkan untuk mendapatkannya dengan bantuan termometer dan air dalam wadah yang terisolasi secara termal: kalorimeter. Skema perangkat ini ditunjukkan pada gambar yang menyertai Latihan 1.
Sampel zat ini direndam pada suhu tertentu dalam jumlah air yang sebelumnya diukur. Suhu akhir diukur dan dengan nilai yang diperoleh panas spesifik dari material ditentukan.
Dapat melayani Anda: Kesalahan acak: rumus dan persamaan, perhitungan, contoh, latihanMembandingkan hasil dengan nilai yang ditabulasi, dapat diketahui zat apa itu. Prosedur ini dipanggil kalorimetri.
Keseimbangan panas dilakukan dengan konservasi energi:
Q Melesat + Q diserap = 0
Latihan terpecahkan
Latihan 1
0 sepotong 0.35 kg pada suhu 150 ºC dalam 500 ml air pada suhu 25 º C. Menemukan:
a) Suhu keseimbangan akhir
b) Berapa banyak panas yang mengalir dalam proses ini?
Data
Ctembaga = 385 J/kg . ºC
Cair = 4180 J/kg . ºC
Kepadatan air: 1000 kg/m3
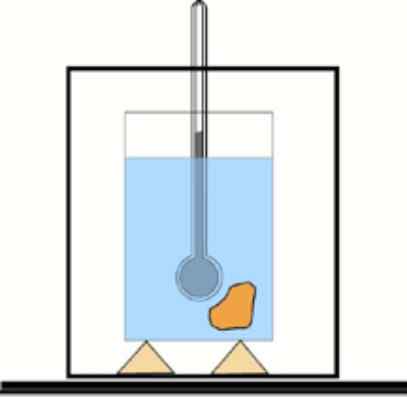 Skema Kalorimeter Dasar: Wadah dengan air terisolasi dan termometer untuk mengukur perubahan suhu. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Skema Kalorimeter Dasar: Wadah dengan air terisolasi dan termometer untuk mengukur perubahan suhu. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Larutan
a) Tembaga memberi panas saat air menyerapnya. Karena sistem dianggap tertutup, hanya air dan sampel campur tangan dalam keseimbangan panas:
Q Melesat = Q terserap
Di sisi lain, perlu menghitung massa 500 mL air:
500 ml = 0.5 l = 0.0005 m3
Dengan data ini, massa air dihitung:
massa = kepadatan x volume = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Persamaan panas dinaikkan di setiap zat:
QMelesat = -mtembaga . Ctembaga. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (tF - 150) J
Qterserap = mair . Cair. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Menyamakan hasil yang Anda miliki:
2093 (tF - 25) = -134.75 (tF - 150)
Ini adalah persamaan linier dengan yang tidak diketahui, yang solusinya adalah:
TF = 32.56 ºC
b) Jumlah panas yang mengalir adalah panas yang ditetapkan atau panas yang diserap:
Q Melesat = - 134.75 (32.56 - 150) j = 15823 j
Q terserap = 2093 (32.56 - 25) j = 15823 j
Latihan 2
Sepotong tembaga 100 g dipanaskan dalam oven hingga suhu Tsalah satu Dan kemudian dimasukkan ke dalam kalorimeter tembaga 15 g yang mengandung 200 g air pada 16 º C. Suhu akhir sekali dalam keseimbangan adalah 38 º C. Ketika kalorimeter dan isinya ditimbang, ditemukan bahwa saya telah menguap.2 g air berapa suhu awal tsalah satu?
Dapat melayani Anda: Worm Hole: Sejarah, Teori, Jenis, FormasiData: Panas laten penguapan air adalah Lv = 2257 kJ/kg
Larutan
Latihan ini berbeda dari yang sebelumnya, karena harus dipertimbangkan bahwa kalorimeter juga menyerap panas. Panas yang ditugaskan oleh potongan tembaga diinvestasikan dalam semua hal berikut:
- Panaskan air dari kalorimeter (200 g)
- Panaskan tembaga di mana kalorimeter dibuat (150 g)
- Menguap 1.2 gram air (untuk perubahan fase Anda juga membutuhkan energi).
QMelesat = -100 X 1 x 10 -3 kg. 385 J/kg . ºC. (38 - tsalah satu ) ºC = -38.5. (38 - tsalah satu) J
Q diserap olehnya kalorimeter = Q diserap oleh air + Q penguapan + Q diserap oleh tembaga
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 j = 22397.3 j
Karena itu:
-38.5. (38 - tsalah satu) = 22397.3
Tsalah satu = 619.7 ºC
Panas yang diperlukan untuk membawa 1 juga bisa dipertimbangkan.2 g air hingga 100 º C, tetapi jumlahnya cukup kecil dibandingkan.
Referensi
- Giancoli, d. 2006. Fisika: Prinsip dengan aplikasi. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Fisika: Pandangan Dunia. 6ta Edisi Singkat. Pembelajaran Cengage. 156 - 164.
- Rex, a. 2011. Dasar -dasar fisika. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisika Universitas dengan Fisika Modern. 14th. Ed. Volume 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Dasar -dasar fisika. 9na Pembelajaran Cengage.
- « Konsep panas sensitif, formula dan latihan diselesaikan
- Definisi, rumus, dan latihan rig faktorial »

