Struktur asam sulfhidrik (H2S), sifat, penggunaan, kepentingan
- 1009
- 246
- Frederick Pfeffer
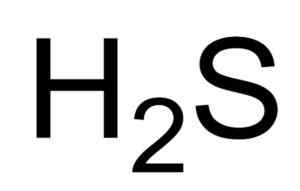
Dia Asam sulfhidrik o Hidrogen sulfida adalah gas yang dibentuk oleh penyatuan atom belerang (S) dan dua atom hidrogen (H). Formula kimianya adalah H2S. Ini juga dikenal sebagai gas sulfida. Itu adalah gas tidak berwarna yang baunya menjadi jelas dalam telur busuk.
Ini ada di gunung berapi dan mata air panas belerang, dalam gas alam dan minyak mentah. Ini juga terbentuk selama dekomposisi anaerob (tanpa oksigen) dari bahan dan bahan organik hewan. Itu terjadi secara alami dalam tubuh mamalia, melalui aksi enzim tertentu pada sistein, asam amino yang tidak penting.
 Formula kimia asam sulfhidrik atau hidrogen sulfida. Saranphong Yimklan [domain publik]. Sumber: Wikimedia Commons.
Formula kimia asam sulfhidrik atau hidrogen sulfida. Saranphong Yimklan [domain publik]. Sumber: Wikimedia Commons. Solusi berair H2S adalah korosif untuk logam seperti baja. H2S adalah senyawa pereduksi yang, saat bereaksi dengan SO2 , Itu mengoksidasi belerang elementer sambil mengurangi menjadi2 Juga untuk belerang.
Meskipun merupakan senyawa yang sangat beracun dan fatal bagi manusia dan hewan, selama beberapa tahun kepentingannya telah dipelajari dalam serangkaian proses penting dalam tubuh.
Mengatur serangkaian mekanisme yang terkait dengan generasi pembuluh darah baru dan fungsi jantung.
Melindungi neuron dan memikirkan tindakannya terhadap penyakit seperti Parkinson dan Alzheimer.
Karena pereduksi kimianya dapat melawan spesies pengoksidasi, sehingga bertindak melawan penuaan sel. Karena alasan ini, kemungkinan memproduksi obat sedang dipelajari bahwa ketika dipasok ke pasien dapat secara perlahan melepaskannya di dalam tubuh.
Ini akan berfungsi untuk mengobati patologi seperti iskemia, diabetes dan penyakit neurodegeneratif. Namun, mekanisme tindakan mereka dan keamanan mereka masih harus diselidiki secara mendalam.
[TOC]
Struktur
Molekula h2S analog dengan air, yaitu, mereka menyerupai bentuknya karena hidrogen terletak membentuk sudut dengan belerang.
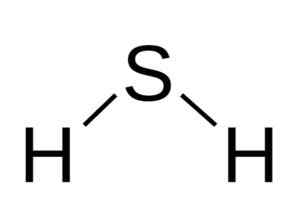 Struktur sudut molekul asam sulfida, h2S. Bangin [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Struktur sudut molekul asam sulfida, h2S. Bangin [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons. Belerang di h2S memiliki konfigurasi elektronik berikut:
1s2, 2s2 2 p6, 3S2 3p6,
Kemudian ambil elektron dari masing -masing hidrogen untuk menyelesaikan lapisan valensinya.
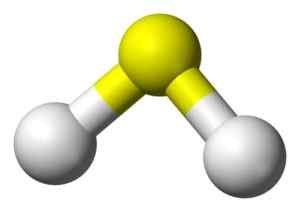 Struktur 3D asam sulfida. Kuning: Sulfur. Putih: Hidrogen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur 3D asam sulfida. Kuning: Sulfur. Putih: Hidrogen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Tata nama
- Asam sulfhidrik
- Hidrogen sulfida
- Belerang hidrida.
Properti fisik
Keadaan fisik
Gas tidak berwarna dari bau yang sangat tidak menyenangkan.
Berat molekul
34.08 g/mol.
Titik lebur
-85.60 ºC.
Titik didih
-60.75 ºC.
Kepadatan
1.1906 g/l.
Kelarutan
Sedang Sedang Air: 2,77 Volume dalam 1 Air Pada 20 ºC. Itu dapat diusir dari larutan berair sepenuhnya dengan mengirimkannya hingga mendidih.
Sifat kimia
Dalam larutan berair
Saat hidrogen sulfida dalam larutan berair, nama asam sulfhidrat ditetapkan. Itu adalah asam yang lemah. Ini memiliki dua proton terionisasi:
H2S + H2Atau ⇔ h3SALAH SATU+ + HS-, KA1 = 8.9 x 10-8
HS- + H2Atau ⇔ h3SALAH SATU+ + S2-, KA2 ∼ 10-14
Proton pertama terionisasi ringan, seperti yang dapat disimpulkan dari konstanta ionisasi pertamanya. Proton kedua sangat sedikit terionisasi, tetapi solusi H2S mengandung sesuatu dari sulfur anion s2-.
Jika solusi H2S terpapar ke udara, o2 oksida ke anion sulfida dan endapan sulfur:
Dapat melayani Anda: oksida2 s2- + 4 h+ + SALAH SATU2 → 2 H2O + 2 s0↓ (1)
Di hadapan klorin CL2, Bromo Br2 dan yodium i2 Hidrogen dan belerang yang sesuai terbentuk:
H2S + BR2 → 2 HBR + S0↓ (2)
Solusi berair H2S adalah korosif, menghasilkan retak tegangan dengan sulfida pada baja keras tinggi. Produk korosi adalah zat besi dan hidrogen sulfida.
Reaksi oksigen
H2S bereaksi dengan oksigen udara dan reaksi berikut dapat terjadi:
2 h2S + 3 O2 → 2 H2O + 2 Jadi2 (3)
2 h2S + o2 → 2 H2O + 2 s0↓ (4)
Reaksi dengan logam
Bereaksi dengan berbagai logam yang bergerak ke hidrogen dan membentuk logam sulfida:
H2S + PB → PBS + H2↑ (5)
Reaksi dengan sulfur dioksida
Dalam gas vulkanik, H hadir2S dan begitu2, yang bereaksi satu sama lain dan sulfur padat terbentuk:
H2S + Jadi2 → 2 H2O + 3 s0↓ (6)
Dekomposisi dengan suhu
Hidrogen sulfida tidak terlalu stabil, mudah dipatahkan dengan pemanasan:
H2S → H2↑ + s0↓ (7)
Lokasi di alam
Gas ini secara alami ditemukan di mata air panas sulfida atau sulfurus, dalam gas vulkanik, dalam minyak mentah dan gas alam.
 Air belerang manantial. Николай максимович [cc by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons.
Air belerang manantial. Николай максимович [cc by 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons. Saat minyak (atau gas) mengandung jejak H yang signifikan2S dikatakan "asam", berbeda dengan "manis", yaitu saat tidak mengandungnya.
Sejumlah kecil h2S dalam minyak atau gas secara ekonomi berbahaya karena pabrik cuci harus dipasang untuk menghapusnya, baik untuk mencegah korosi dan untuk membuat gas residu aman untuk penggunaan domestik sebagai bahan bakar.
Ini terjadi setiap kali bahan organik yang mengandung sulfur terurai dalam kondisi anaerob (tidak adanya udara), seperti manusia, hewan dan limbah tanaman.
 H emisi2S (warna hijau kebiruan) di pantai Namibia, difoto oleh NASA. Emisi ini berasal dari limbah organik. Observatorium Bumi NASA [CC dengan 2.0 (https: // createveCommons.Org/lisensi/oleh/2.0)]. Sumber: Wikimedia Commons.
H emisi2S (warna hijau kebiruan) di pantai Namibia, difoto oleh NASA. Emisi ini berasal dari limbah organik. Observatorium Bumi NASA [CC dengan 2.0 (https: // createveCommons.Org/lisensi/oleh/2.0)]. Sumber: Wikimedia Commons. Bakteri yang ada di mulut dan di saluran pencernaan menghasilkannya dari bahan yang terdegrada yang mengandung sayuran atau protein hewani.
Bau khasnya menyebabkan kehadirannya dalam telur busuk diperingatkan.
H2S Ini juga terjadi dalam kegiatan industri tertentu, seperti di kilang minyak, oven kokas, pabrik kertas, Anda akan dan dalam pengolahan makanan.
Sintesis dalam tubuh mamalia
H2S endogen dapat terjadi pada jaringan mamalia, di antara manusia ini, dengan dua jalur, enzimatik dan non -enzymatic.
Jalur non -enzymatic terdiri dari mengurangi sulfur dasar0 untuk h2S melalui oksidasi glukosa:
2 c6H12SALAH SATU6 (glukosa) + 6 s0 (belerang) + 3 jam2O → 3 c3H6SALAH SATU3 + 6 h2S + 3 co2 (8)
Dapat melayani Anda: klorin: sejarah, sifat, struktur, risiko, penggunaanJalan enzimatik terdiri dari h h2S dari l-sistein, yang merupakan asam amino yang disintesis oleh tubuh. Proses ini diasuransikan oleh beberapa enzim, seperti kistasi.
 Asam sulfhidrik telah ditemukan di otak sapi. Penulis: Arttower. Sumber: Pixabay.
Asam sulfhidrik telah ditemukan di otak sapi. Penulis: Arttower. Sumber: Pixabay. Memperoleh di laboratorium atau industri
Gas hidrogen (h2) dan elemen belerang tidak bereaksi terhadap suhu lingkungan normal, tetapi di atasnya mereka mulai digabungkan, suhu optimal menjadi 310 ºC.
Prosesnya tetap terlalu lambat, sehingga metode lain digunakan untuk mendapatkannya, di antara ini yang berikut ini.
Logam sulfida (seperti ferrous sulfida) bereaksi dengan asam (seperti hidroklorik) dalam larutan encer.
FES + 2 HCl → FECL2 + H2S ↑ (9)
Dengan cara ini gas diperoleh2S yang, diberi toksisitasnya, harus dikumpulkan dengan aman.
Penggunaan industri H2S untuk menghasilkan belerang
Penyimpanan dan transportasi dalam jumlah h dalam jumlah besar2S yang terpisah dari gas alam dengan mencuci dengan amina itu sulit, jadi proses klausa digunakan untuk mengubahnya menjadi belerang.
 Di kilang minyak h dipisahkan2S dari gas alam dengan mencuci dengan amina dan kemudian menjadi belerang. Penulis: Satyaprem. Sumber: Pixabay.
Di kilang minyak h dipisahkan2S dari gas alam dengan mencuci dengan amina dan kemudian menjadi belerang. Penulis: Satyaprem. Sumber: Pixabay. Dalam proses ini dua reaksi terjadi. Di pertama h2S bereaksi dengan oksigen untuk diberikan2, Seperti disebutkan di atas (lihat reaksi 3).
Yang kedua adalah reaksi yang dikatalisis oleh oksida besi di mana SO2 berkurang dan h2S teroksidasi, dan keduanya menghasilkan sulfur (lihat reaksi 6).
Dengan cara ini, sulfur diperoleh, yang dapat dengan mudah disimpan dan diangkut, serta dialokasikan untuk beberapa penggunaan.
Utilitas atau pentingnya h2S endogen dalam organisme
H2S endogen adalah yang terjadi secara alami dalam organisme sebagai bagian dari metabolisme normal pada manusia, mamalia dan makhluk hidup lainnya.
Terlepas dari reputasinya yang panjang sebagai gas beracun dan beracun yang terkait dengan dekomposisi bahan organik, beberapa penelitian terbaru dari tahun 2000 hingga saat ini telah menentukan bahwa H2S endogen adalah pengatur penting dari mekanisme dan proses tertentu dalam makhluk hidup.
H2S menghadirkan lipofilitas tinggi atau afinitas terhadap lemak, sehingga melintasi membran sel dengan mudah, menembus semua jenis sel.
Sistem kardiovaskular
Pada mamalia, asam sulfida mempromosikan atau mengatur serangkaian sinyal yang mengatur metabolisme, fungsi jantung dan kelangsungan hidup sel.
Ini memberikan efek yang kuat pada jantung, pembuluh darah dan unsur -unsur darah yang beredar. Memodulasi metabolisme seluler dan fungsi mitokondria.
Membela ginjal kerusakan yang disebabkan oleh iskemia.
Sistem gastrointestinal
Mainkan peran penting sebagai faktor pelindung terhadap kerusakan pada mukosa lambung. Diperkirakan menjadi mediator penting dari motilitas gastrointestinal.
Kemungkinan itu terlibat dalam kontrol sekresi insulin.
Sistem syaraf pusat
Ini juga bertindak dalam fungsi penting dari sistem saraf pusat dan melindungi neuron stres oksidatif.
 Neuron dilindungi oleh H2S endogen. Penulis: Gerd Altmann. Sumber: Pixabay.
Neuron dilindungi oleh H2S endogen. Penulis: Gerd Altmann. Sumber: Pixabay. Diperkirakan dapat melindungi terhadap penyakit neurodegeneratif seperti Parkinson's Parkinson, Alzheimer dan Penyakit Hunginton.
Organ penglihatan
Lindungi sel fotoreseptor dari degenerasi retina yang disebabkan oleh cahaya.
Itu dapat melayani Anda: lithium karbonat (li2co3): struktur, sifat, penggunaanMelawan penuaan
H2S menjadi spesies pereduksi dapat dikonsumsi oleh berbagai agen pengoksidasi yang beredar di dalam tubuh. Tempur mengoksidasi spesies seperti spesies oksigen reaktif dan spesies nitrogen reaktif dalam tubuh.
Batasi reaksi radikal bebas melalui aktivasi enzim antioksidan yang melindungi terhadap efek penuaan.
Potensi penyembuhan h2S disediakan secara eksogen
Ketersediaan hayati h2S endogenik tergantung pada enzim tertentu yang terlibat dalam biosintesis sistein pada mamalia.
Beberapa penelitian menunjukkan bahwa donor terapi obat don2S bisa bermanfaat untuk patologi tertentu.
Sebagai contoh, ini bisa berguna pada pasien diabetes, karena telah diamati bahwa pembuluh darah hewan diabetes membaik dengan obat -obatan yang memasok H2S eksogen.
H2S Disediakan secara eksogen meningkatkan angiogenesis atau pembentukan pembuluh darah, sehingga dapat berfungsi untuk pengobatan penyakit iskemia kronis.
Obat -obatan sedang dirancang yang dapat melepaskan h2S perlahan -lahan untuk dapat bertindak secara menguntungkan tentang berbagai penyakit. Namun, efektivitas, keamanan, dan mekanisme tindakan mereka masih harus diselidiki.
Risiko
H2S adalah racun yang fatal jika dihirup murni atau bahkan encer 1 bagian gas di 200 bagian udara. Burung sangat sensitif terhadap h2S dan mati bahkan dalam pengenceran 1 dalam 1500 bagian udara.
 Asam sulfida atau hidrogen sulfida H2S adalah racun yang kuat. Penulis: Openicons. Sumber: Pixabay.
Asam sulfida atau hidrogen sulfida H2S adalah racun yang kuat. Penulis: Openicons. Sumber: Pixabay. H2S adalah inhibitor yang kuat dari enzim tertentu dan proses fosforilasi oksidatif, yang mengarah ke mati lemas sel. Kebanyakan orang menganggapnya dalam konsentrasi lebih dari 5 ppb (bagian per miliar). Konsentrasi 20-50 ppm (bagian per juta) mengiritasi mata dan saluran pernapasan.
Menghirup 100-250 ppm selama beberapa menit dapat menghasilkan kurangnya koordinasi, gangguan memori dan gangguan motorik. Ketika konsentrasi sekitar 150-200 ppm2S. Jika konsentrasi 500 ppm dihirup selama 30 menit, edema paru dan pneumonia dapat diproduksi.
Konsentrasi lebih dari 600 ppm bisa berakibat fatal dalam 30 menit pertama, karena sistem pernapasan lumpuh. Dan 800 ppm adalah konsentrasi yang segera mematikan bagi manusia.
Oleh karena itu, harus dihindari bahwa ada hol2Di laboratorium, lokal atau di mana saja atau situasi.
Penting untuk mengingatkan bahwa banyak kematian terjadi karena orang masuk ke ruang yang terbatas untuk menyelamatkan rekan kerja atau anggota keluarga yang telah pingsan karena keracunan dengan h2S, sekarat juga.
Itu adalah gas yang mudah terbakar.
Referensi
- Panthi, s. et al. (2016). Pentingnya fisiologis hidrogen sulfida: neuroprotektor potnt dan neuromodulator yang muncul. Pengobatan oksidatif dan umur panjang seluler. Volume 2016. Artikel ID 9049782. Hyndawi pulih.com.
- Shefa, u. et al. (2018). Fungsi antioksidan dan pensinyalan sel hidrogen sulfida dalam sistem saraf pusat. Pengobatan oksidatif dan umur panjang seluler. Volume 2018. ID Artikel 1873962. Hyndawi pulih.com.
- Tabassum, r. et al. (2020). Pentingnya terapeutik hidrogen sulfida dalam penyakit neurodegeneratif terkait usia. Neural Regen Res 2020; 15: 653-662. Nrronline pulih.org.
- Martelli, a. et al. (2010). Hidrogen sulfida: Peluang baru untuk penemuan obat. Ulasan Penelitian Obat. Volume 32, Edisi 6. Diperoleh dari perpustakaan online.Wiley.com.
- Wang, m.-J. et al. (2010). Mekanisme angiogesis: Peran hidrogen sulfida. Farmakologi dan Fisiologi Klinis dan Eksperimental (2010) 37, 764-771. Diperoleh dari perpustakaan online.Wiley.com.
- Dalefield, r. (2017). Asap dan toksikonten inhalasi lainnya. Hidrogen sulfida. Dalam Toksikologi Hewan untuk Australia dan Selandia Baru. Pulih dari scientedirect.com.
- Selley, R.C. dan sonnenberg, s.KE. (2015). Sifat fisik dan kimia minyak bumi. Hidrogen sulfida. In Elements of Petroleum Geology (Edisi Ketiga). Pulih dari scientedirect.com.
- Hocking, m.B. (2005). Asam belerang dan sulfat. Konversi proses klausa hidrogen sulfida menjadi belerang. Dalam Buku Pegangan Teknologi Kimia dan Pengendalian Polusi (Edisi Ketiga). Pulih dari scientedirect.com.
- Lefer, d.J. (2008). Potensi pentingnya perubahan dalam hidrogen sulfida (h2S) bioavailabilitas pada diabetes. British Journal of Pharmacology (2008) 155, 617-619. Diperoleh dari BPSPub.Perpustakaan Online.Wiley.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Hidrogen sulfida. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah.
- Port, J.KE. dan Ibarz, J. (1965). Kimia Umum Modern. Edisi ke -7. Editorial marín, s.KE.
- « Origin Pendidikan Sosialis, Karakteristik, Prinsip, Contoh
- Sejarah Teater Neoklasik, Karakteristik, Perwakilan, Karya »

