Perbedaan antara senyawa organik dan anorganik

- 1517
- 7
- Mr. Darrell Streich
Itu Perbedaan antara senyawa organik dan anorganik Mereka tidak selalu sederhana, mereka juga tidak mematuhi aturan yang tidak dapat diubah, karena dalam hal kimia ada simfin pengecualian yang bertentangan atau mempertanyakan pengetahuan sebelumnya. Namun, ada karakteristik yang memungkinkan untuk membedakan di antara banyak senyawa yang atau tidak anorganik.
Menurut definisi, kimia organik adalah penelitian yang mencakup semua cabang kimia karbon; Oleh karena itu, logis untuk berpikir bahwa kerangka mereka terdiri dari atom karbon. Di sisi lain, kerangka anorganik (tanpa memasuki polimer) biasanya terdiri dari elemen lain dari tabel periodik selain karbon.
Makhluk hidup, pada semua skala dan ekspresi mereka, praktis terbuat dari karbon dan heteroátomos lainnya (H, O, N, P, S, dll.). Jadi semua tanaman hijau yang menutupi kerak bumi, serta makhluk -makhluk yang berjalan di atasnya, adalah contoh hidup dari senyawa organik yang beragam yang kompleks dan secara dinamis.
Di sisi lain, mengebor bumi dan di pegunungan kita menemukan badan mineral yang kaya dalam komposisi dan bentuk geometris, yang sebagian besar adalah senyawa anorganiknya. Yang terakhir juga mendefinisikan hampir seluruhnya atmosfer yang kita hirup, dan lautan, sungai dan danau.
Senyawa organik | Senyawa anorganik | |
Atom yang menyusunnya | Mereka mengandung atom karbon. | Mereka terdiri dari elemen selain karbon. |
Mereka adalah bagian dari .. | Adalah bagian dari makhluk hidup. | Mereka adalah bagian dari makhluk inert. |
Sumber di mana mereka berada | Mereka kurang berlimpah dalam sumber alami. | Mereka lebih berlimpah dalam sumber alami. |
Jenis senyawa | Mereka biasanya molekuler. | Mereka biasanya ionik. |
Jenis tautan | Tautan kovalen. | Tautan ionik. |
Massa molar | Massa molar yang lebih besar. | Massa molar bawah. |
Keberagaman | Mereka kurang beragam. | Mereka adalah elemen yang lebih beragam. |
Fusion dan titik didih | Fusion kecil dan titik mendidih. | Poin fusi dan boil yang lebih tinggi. |
Perbedaan utama antara senyawa organik dan anorganik
Senyawa anorganik diperoleh dari sumber alami yang lebih berlimpah daripada senyawa anorganik
 Kristal gula (kanan) dan garam (kiri) terlihat di mikroskop. Sumber: Oleg Panichev [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Kristal gula (kanan) dan garam (kiri) terlihat di mikroskop. Sumber: Oleg Panichev [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Meskipun mungkin ada pengecualian, senyawa anorganik biasanya diperoleh dari sumber alami yang lebih banyak daripada yang untuk senyawa organik. Perbedaan pertama ini mengarah pada pernyataan tidak langsung: senyawa anorganik lebih banyak (di bumi dan di kosmos) daripada senyawa organik.
Tentu saja, di lokasi minyak, hidrokarbon dan predominasi terkait akan mendominasi, yang merupakan senyawa organik.
Kembali ke bagian, dapat disebutkan di garam gula sebagai contoh. Kristal gula (lebih kuat dan faceted) dan garam ditunjukkan di atas (lebih kecil dan bulat).
Gula diperoleh, setelah serangkaian proses, dari perkebunan tebu (di daerah yang cerah atau tropis) dan bit gula (di daerah dingin atau di awal musim dingin atau musim gugur). Keduanya adalah bahan baku alami dan terbarukan, yang ditanam sampai panen yang tepat.
Dapat melayani Anda: standardisasi solusiSementara itu, garam berasal dari sumber yang jauh lebih berlimpah: laut, atau danau dan garam seperti Halita Mineral (NaCl). Jika semua bit tebu dan gula dikumpulkan, mereka tidak akan pernah bisa cocok dengan cadangan garam alami.
Kristal anorganik biasanya ionik sedangkan kristal organik cenderung molekul
Mengambil pasangan eks-gula lagi sebagai contoh, kita tahu bahwa gula terdiri dari disakarida yang disebut sukrosa, yang pada gilirannya hancur menjadi unit glukosa dan fruktosa lainnya. Kristal gula bersifat molekuler, karena didefinisikan oleh sukrosa dan jembatan hidrogen antar molekulnya.
Sementara itu, kristal garam merupakan jaringan ion na+ dan Cl-, yang menentukan struktur kubik yang berpusat di wajah (FCC).
Titik pusat adalah bahwa senyawa anorganik biasanya membentuk kristal ionik (atau setidaknya, memiliki karakter ionik tinggi). Namun, ada beberapa pengecualian, seperti kristal co2, H2S, jadi2 dan gas anorganik lainnya, yang memperkuat pada suhu rendah dan tekanan tinggi, dan juga molekuler.
Air mewakili pengecualian paling penting untuk titik ini: es adalah kristal anorganik dan molekul.
 Beberapa salju atau es adalah kristal air, contoh yang sangat baik dari kristal molekul anorganik. Sumber: Sieverschar de Pixabay.
Beberapa salju atau es adalah kristal air, contoh yang sangat baik dari kristal molekul anorganik. Sumber: Sieverschar de Pixabay. Mineral pada dasarnya adalah senyawa anorganik, dan karena itu kristal -kristalnya sebagian besar adalah ionik. Itulah sebabnya poin kedua ini dianggap valid untuk spektrum luas senyawa anorganik, termasuk garam, sulfida, oksida, telluros, dll.
Jenis tautan yang mengatur dalam senyawa organik adalah kovalen
Gula dan kristal garam yang sama meninggalkan sesuatu pertanyaan: yang pertama mengandung tautan kovalen (terarah), sedangkan yang terakhir menunjukkan tautan ionik (non -dirireksi) (non -directional).
Poin ini berkorelasi langsung dengan yang kedua: kristal molekul harus memiliki beberapa ikatan kovalen (berbagi beberapa elektron antara dua atom).
Sekali lagi, garam organik menetapkan pengecualian tertentu, karena mereka juga memiliki karakter ionik yang kuat; Misalnya, natrium benzoat (c6H5Pata) adalah garam organik, tetapi di dalam benzoat dan cincin aromatiknya ada ikatan kovalen. Meski begitu, dikatakan bahwa kristal mereka adalah ionik mengingat interaksi elektrostatik: c6H5Mendekut- Na+.
Dalam senyawa organik ikatan kovalen antara atom karbon mendominasi
Atau apa yang sama untuk dikatakan: senyawa organik terdiri dari kerangka berkarbonasi. Di dalamnya ada lebih dari satu ikatan C-C atau C-H, dan kerangka ini bisa linier, lear, atau bercabang, bervariasi dalam tingkat ketidakjenuhan mereka dan jenis substituen (heteroaátomos atau kelompok fungsional). Dalam tautan gula, C-C, C-H dan C-OH.
Itu dapat melayani Anda: reduksi agen: konsep, terkuat, contohMari kita beri contoh CO, ch2Och2 dan H2C2SALAH SATU4. Manakah dari ketiga senyawa ini yang anorganik?
Di ch2Och2 (Ethylene dioksida) Ada empat ikatan C-H dan dua tautan C-O, sedangkan di H2C2SALAH SATU4 (asam oksalat) Ada satu C-C, dua C-OH dan dua C = O. Struktur h2C2SALAH SATU4 Itu dapat ditulis sebagai hooc-cooh (dua kelompok karboksil tertaut). Sementara itu, CO terdiri dari molekul yang biasanya diwakili dengan ikatan hibrida antara c = o dan cunjungi.
Karena dalam CO (karbon monoksida) hanya ada atom karbon yang terkait dengan salah satu oksigen, gas ini bersifat anorganik; Senyawa lainnya adalah organik.
Senyawa organik biasanya memiliki massa molar yang lebih besar
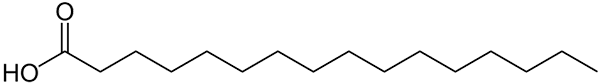 Struktur diwakili dengan garis asam palmitat. Hal besar yang dibandingkan dengan senyawa anorganik yang lebih kecil, atau berat formula garamnya dapat diperhatikan. Sumber: Wolfgang Schaefer [domain publik]
Struktur diwakili dengan garis asam palmitat. Hal besar yang dibandingkan dengan senyawa anorganik yang lebih kecil, atau berat formula garamnya dapat diperhatikan. Sumber: Wolfgang Schaefer [domain publik] Sekali lagi, ada banyak pengecualian untuk aturan ini, tetapi biasanya senyawa organik cenderung memiliki massa molar yang lebih besar karena kerangka berkarbonasi mereka.
Misalnya, molar dari senyawa di atas adalah: 28 g/mol (CO), 90 g/mol (h2C2SALAH SATU4) dan 60 g/mol (pilih2Och2). Tentu saja, CS2 (Karbon disulfida), senyawa anorganik dan yang massa molarnya 76 g/mol, "berbobot" lebih dari cho2Och2.
Tapi bagaimana dengan lemak atau asam lemak? Biomolekul seperti DNA atau protein? Atau hidrokarbon rantai linier yang luas? Atau asphaltene? Massa molarnya dengan mudah melebihi 100 g/mol. Asam palmitat (gambar atas), misalnya, memiliki adonan molar 256 g/mol.
Senyawa organik lebih banyak jumlahnya
Beberapa senyawa anorganik, yang disebut kompleks koordinasi, hadir isomeía. Namun, ini kurang beragam dibandingkan dengan isomeria organik.
Bahkan jika kita menambahkan semua garam, oksida (logam dan non -metalik), sulfida, telururo, karbida, hidrida, nitrida, dll., Kami tidak akan berkumpul mungkin bahkan tidak setengah dari senyawa organik yang mungkin ada di alam. Oleh karena itu, senyawa organik lebih banyak jumlahnya dan lebih kaya dalam struktur.
Senyawa anorganik lebih beragam
Namun, menurut keanekaragaman dasar, senyawa anorganik lebih bervariasi. Karena? Karena dengan tabel periodik di tangan Anda dapat membangun semua jenis senyawa anorganik; Sementara senyawa organik hanya terbatas pada elemen: C, h, o, p, s, n, dan x (halogen).
Kami memiliki banyak logam (alkali, alkalin, transisi, lantanida, aktinid, blok P), dan infinitas opsi untuk menggabungkannya dengan beberapa anion (anorganik biasa); seperti: CO32- (Karbonat), CL- (Klorida), p3- (fosfur), atau2- (oksida), oh- (hidroksida), jadi42- (sulfat), CN- (sianida), SCN- (Tiocianates), dan banyak lagi.
Perhatikan bahwa anion CN- dan scn- Mereka tampaknya organik, tetapi mereka sebenarnya anorganik. Kebingungan lainnya adalah anion oksalat, c2SALAH SATU42-, yang organik dan non -asorganik.
Dapat melayani Anda: aturan diagonalSenyawa anorganik memiliki titik fusi dan didih yang lebih tinggi
Sekali lagi, ada beberapa pengecualian untuk aturan ini, karena semuanya tergantung pada pasangan senyawa mana yang dibandingkan. Namun, menempel pada garam anorganik dan organik, yang pertama biasanya memiliki titik fusi dan didih yang lebih besar daripada yang terakhir.
Di sini kita menemukan titik implisit lainnya: Garam organik rentan untuk membusuk, karena panas memecahkan ikatan kovalennya. Meski begitu, kami membandingkan Par kalsium tartrato (CAC4H4SALAH SATU6) dan kalsium karbonat (caco3). CAC4H4SALAH SATU6 Ini terurai pada 600 ° C, sedangkan maco3 Itu meleleh pada 825 ° C.
Dan itu Caco3 jauh dari menjadi salah satu garam dengan titik lebur tertinggi, seperti dalam kasus CAC2 (2160 ºC) dan CAS2 (2525 ºC): masing -masing karbur dan kalsium sulfida.
Senyawa organik lebih jarang di alam semesta
Senyawa organik yang paling sederhana dan paling primitif, seperti metana, cho4, Urea, co (NH2)2, atau asam amino glikina, NH2Ch2COOH, adalah spesies yang sangat langka dalam kosmos dibandingkan dengan amonia, karbon dioksida, titanium oksida, batubara, dll. Di alam semesta bahkan bahan pendahulu kehidupan tidak sering terdeteksi.
Senyawa organik mendukung kehidupan ke tingkat yang jauh lebih besar daripada anorganik
 Cangkang morrocoy terdiri dari campuran tulang yang ditutupi oleh keratin, yang terdiri dari matriks anorganik (hidroksiapatit dan mineral terkait) dan organik (kolagen, tulang rawan dan saraf). Sumber: morrocoy_ (geochelone_carbonary).Jpg: fotografi.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Cangkang morrocoy terdiri dari campuran tulang yang ditutupi oleh keratin, yang terdiri dari matriks anorganik (hidroksiapatit dan mineral terkait) dan organik (kolagen, tulang rawan dan saraf). Sumber: morrocoy_ (geochelone_carbonary).Jpg: fotografi.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Kimia Karbon, Organik, diterapkan dalam pemahaman proses metabolisme, menjadi biokimia (dan dari sudut pandang kation logam, dalam bioinorganik).
Senyawa organik adalah landasan kehidupan (seperti morrocoy dari gambar atas), berkat tautan C-C dan konglomerat besar struktur yang dihasilkan dari tautan ini, dan interaksinya dengan kristal garam anorganik.
Kembali ke pasangan garam gula, sumber-sumber alami gula hidup: mereka adalah tanaman yang berkembang dan mati; Tetapi itu tidak terjadi sama dengan sumber garam: lautan atau endapan saline masih hidup (dalam arti fisiologis).
Tumbuhan dan hewan mensintesis senyawa organik yang tak ada habisnya, yang mengintegrasikan berbagai produk alami (vitamin, enzim, hormon, lemak, pewarna, dll.).
Namun, kita tidak dapat meninggalkan fakta bahwa air adalah pelarut kehidupan (dan bersifat anorganik); Atau oksigen itu sangat diperlukan untuk respirasi seluler (tanpa penamaan kofaktor logam, yang bukan senyawa anorganik tetapi kation). Oleh karena itu, anorganik juga memainkan peran penting dalam definisi kehidupan.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (3 Juli 2019). Perbedaan antara organik dan anorganik. Pulih dari: thinkco.com
- Badan Pendidikan Texas. (2019). Organik atau anorganik? Pulih dari: Texasgateway.org
- Sukrosa. (S.F.). Bagaimana Gula Dibuat: Pengantar. Dipulihkan dari: Sucrosa.com
- Wikipedia. (2019). Daftar senyawa anorganik. Diperoleh dari: di.Wikipedia.org
- « Perbedaan antara kecepatan dan kecepatan (dengan contoh)
- 10 dinamika kecerdasan emosional untuk anak -anak dan orang dewasa »

