Struktur aluminium phosphuro (AIP), sifat, penggunaan, risiko

- 3350
- 843
- Joseph Nader PhD
Dia Aluminium fosfida Ini adalah senyawa anorganik yang dibentuk oleh atom aluminium (AL) dan atom fosfor (P). Formula kimianya alp. Itu adalah padatan abu -abu gelap atau, jika sangat murni, kuning. Ini adalah senyawa yang sangat beracun untuk makhluk hidup.
Fosfur aluminium bereaksi dengan kelembaban untuk membentuk pH fosfin atau fosfano3, yang merupakan gas beracun. Karena alasan ini, ALP tidak boleh menghubungi air. Bereaksi kuat dengan asam dan larutan basa.
 Aluminium fosfida. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons.
Aluminium fosfida. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons. Itu digunakan di masa lalu untuk menghilangkan hama seperti serangga dan hewan pengerat di tempat -tempat di mana biji -bijian sereal dan produk pertanian lainnya disimpan. Namun, karena bahaya yang tinggi telah dilarang di sebagian besar negara di dunia.
Saat ini, kegunaannya di area elektronik secara teoritis diselidiki melalui komputer yang menghitung kemungkinan mendapatkan semikonduktor ALP nanotube, yaitu tabung yang sangat kecil yang dapat mentransmisikan listrik hanya dalam kondisi tertentu.
Aluminium Phosphuro adalah senyawa yang sangat berbahaya, harus dimanipulasi dengan peralatan keamanan seperti sarung tangan, lensa, peralatan pernapasan dan pakaian pelindung.
[TOC]
Struktur
ALP Aluminium Phosphuro dibentuk oleh penyatuan atom aluminium pada fosfor P atom P. Tautan antara keduanya adalah kovalen dan triple, oleh karena itu sangat kuat.
Aluminium di ALP memiliki keadaan oksidasi +3 dan fosfor memiliki valensi -3.
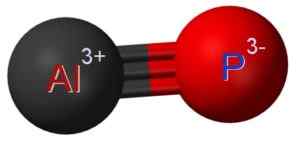 Struktur Aluminium Phosphuro di mana Anda dapat melihat triple link antara atom aluminium (AL) dan fosfor (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur Aluminium Phosphuro di mana Anda dapat melihat triple link antara atom aluminium (AL) dan fosfor (P) (P). Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Tata nama
- Aluminium fosfida
Properti
Keadaan fisik
Solid kristal abu -abu gelap atau kuning gelap. Kristal kubik.
Berat molekul
57.9553 g/mol
Titik lebur
2550 ºC
Kepadatan
2,40 g/cm3 pada 25 ° C
Kelarutan
Itu membusuk di dalam air.
Sifat kimia
Bereaksi dengan kelembaban untuk memberikan pH fosfin atau fosfano3 yang merupakan senyawa yang mudah terbakar dan beracun. Fosfin atau fosfaan.
Dapat melayani Anda: Gadolinio: Struktur, Properti, Memperoleh, PenggunaanReaksi aluminium fosfuro dengan air adalah sebagai berikut:
Aluminium fosfur + air → aluminium hidroksida + fosfin
ALP + 3 H2O → ke (OH)3 + Ph3↑
Presentasi komersial memiliki aluminium karbonat ke2(BERSAMA3)3 untuk mencegah self -rasion fosfin yang terjadi ketika ALP bersentuhan dengan kelembaban udara.
ALP stabil saat kering. Bereaksi dengan keras dengan asam dan larutan basa.
Aluminium aluminium fosfur tidak meleleh, atau sublimal atau terurai secara termal pada suhu setinggi 1000 ° C. Bahkan pada suhu ini tekanan uapnya sangat rendah, yaitu, tidak menguap pada suhu itu.
Saat dipanaskan hingga dekomposisinya memancarkan fosfor oksida beracun. Kontak dengan logam Anda dapat memancarkan gas hidrogen yang mudah terbakar h2.
Properti lainnya
Ketika itu murni menunjukkan warna kekuningan, ketika dicampur dengan sisa -sisa reaksi persiapan menghadirkan warna dari abu -abu ke hitam.
Volatilitas rendah tidak termasuk bahwa ia memiliki bau, jadi bau bawang putih yang terkadang memancarkan pH fosfin3 yang terbentuk di hadapan kelembaban.
Memperoleh
Fosfur aluminium dapat diperoleh dengan memanaskan campuran bubuk logam aluminium (AL) dan elemen fosfor merah (P).
Karena afinitas fosfor (P) oleh oksigen (atau2) dan aluminium (al) oleh oksigen dan nitrogen (n2), Reaksi harus dilakukan di atmosfer bebas gas -gas ini, seperti atmosfer hidrogen (h2) atau gas alam.
Reaksi mulai dengan cepat memanaskan area campuran sampai reaksi dimulai, yang eksotermik (panas terjadi selama hal yang sama). Sejak saat itu, reaksi berlangsung dengan cepat.
Aluminium + fosfor → aluminium fosfuro
4 hingga + P4 → 4 Alp
Aplikasi
Dalam penghapusan hama (penggunaan yang dihentikan)
Aluminium Phosphuro digunakan di masa lalu sebagai insektisida dan sebagai pembasmi tikus. Namun, meskipun telah dilarang oleh toksisitasnya, masih digunakan di beberapa bagian dunia.
Dapat melayani Anda: .Asam stearat (CH3 (CH2) 16COOH): Struktur, sifat, penggunaanIni digunakan untuk fumigasi di ruang tertutup di mana produk makanan yang diproses atau tidak diproses ditemukan (seperti sereal), makanan untuk produk hewan dan non -makanan.
Tujuannya adalah untuk mengendalikan serangga dan hewan pengerat yang menyerang artikel yang disimpan, apakah dapat dimakan atau tidak.
Ini memungkinkan pengendali tikus dan serangga di daerah non -domestik, pertanian atau non -pertanian, fumigasi di luar ruangan atau di liang dan sarangnya untuk mencegah penyakit tertentu dari mentransmisikan.
 Tikus dan tikus adalah hama yang menyerang tempat penyimpanan sereal. Beberapa tahun yang lalu mereka bertarung dengan aluminium fosfur. Penulis: Andreas N. Sumber: Pixabay.
Tikus dan tikus adalah hama yang menyerang tempat penyimpanan sereal. Beberapa tahun yang lalu mereka bertarung dengan aluminium fosfur. Penulis: Andreas N. Sumber: Pixabay.  Hewan pengerat dikendalikan dengan menempatkan aluminium fosfur di liang mereka. Penulis: Foto-rabe. Sumber: Pixabay.
Hewan pengerat dikendalikan dengan menempatkan aluminium fosfur di liang mereka. Penulis: Foto-rabe. Sumber: Pixabay. Bentuk penggunaannya terdiri dalam paparan ALP di udara atau kelembaban, karena fosfin atau pH fosfaan dilepaskan3 yang menghasilkan kerusakan pada banyak organ wabah untuk dihilangkan.
 Serangga juga dihilangkan dengan aluminium fosfur ALP. Penulis: Michael Power. Sumber: Buka purba.
Serangga juga dihilangkan dengan aluminium fosfur ALP. Penulis: Michael Power. Sumber: Buka purba. Di aplikasi lain
Aluminium aluminium allik digunakan sebagai sumber fosfin atau pH fosfano3 dan sedang digunakan dalam penelitian semikonduktor.
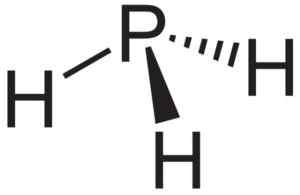 PH fosfaan atau fosfin3, senyawa yang terbentuk saat aluminium aluminium fosfur bersentuhan dengan air. Neuroteker [domain publik]. Sumber: Wikimedia Commons.
PH fosfaan atau fosfin3, senyawa yang terbentuk saat aluminium aluminium fosfur bersentuhan dengan air. Neuroteker [domain publik]. Sumber: Wikimedia Commons. Penelitian Teoritis Nanotube ALP
Studi teoritis telah dilakukan pada pembentukan aluminium fosfur nanotube ALP. Nanotube adalah silinder yang sangat kecil dan sangat tipis yang hanya dapat dilihat dengan mikroskop elektronik.
ALP Nanotube dengan boron
Studi teoritis yang dilakukan melalui perhitungan komputasi menunjukkan bahwa kotoran yang dapat ditambahkan ke nanotube ALP dapat mengubah sifat teoritis dari ini.
Misalnya, diperkirakan menambahkan atom boron (b) ke nanotube ALP dapat mengubahnya menjadi semikonduktor jenis-P. Semikonduktor adalah bahan yang berperilaku sebagai konduktor listrik atau sebagai isolasi tergantung pada medan listrik yang menjadi sasarannya.
Dapat melayani Anda: keadaan plasma: karakteristik, jenis dan contohDan tipe semikonduktor-P Itu adalah ketika bahan ditambahkan kotoran, dalam hal ini ALP adalah bahan awal dan atom boron akan menjadi kotoran. Semikonduktor berguna untuk aplikasi elektronik.
ALP nanotube dengan struktur yang diubah
Beberapa ilmuwan telah melakukan perhitungan untuk menentukan efek mengubah struktur jaringan kristal nanotube ALP dari heksagonal ke oktahedral.
Mereka menemukan bahwa manipulasi struktur jaringan kristal dapat digunakan untuk menyesuaikan konduktivitas dan reaktivitas nanotube ALP dan merancangnya sehingga mereka berguna untuk elektronik dan aplikasi optik.
Risiko
Kontak dengan aluminium fosfur dapat mengiritasi kulit, mata, dan selaput lendir. Jika dicerna atau dihirup, itu beracun. Itu dapat diserap melalui kulit dengan efek beracun.
Jika ALP bersentuhan dengan air bereaksi dan bentuk fosfin atau pH fosfan3 yang sangat mudah terbakar karena terbakar dalam kontak dengan udara. Oleh karena itu dapat dieksploitasi. Selain itu fosfin menyebabkan kematian manusia dan hewan.
Karena pestisida ekonomi adalah aluminium phosphuro, penggunaannya adalah penyebab umum keracunan orang dan melibatkan tingkat kematian yang tinggi.
 Aluminium Phosphuro sangat berbahaya. Penulis: OpenClipart-Vektor. Sumber: Pixabay.
Aluminium Phosphuro sangat berbahaya. Penulis: OpenClipart-Vektor. Sumber: Pixabay. Bereaksi dengan kelembaban selaput lendir dan dengan asam klorida HCl dari lambung yang membentuk gas pH fosfana yang sangat beracun3. Oleh karena itu, dengan inhalasi dan konsumsi, fosfin terbentuk di dalam tubuh, dengan efek fatal.
Konsumsinya menyebabkan perdarahan pada saluran pencernaan, keruntuhan kardiovaskular, gangguan neuropsikiatri, gagal pernapasan dan ginjal dalam beberapa jam.
ALP sangat beracun bagi semua hewan terestrial dan air.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Aluminium fosfida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Sjögren, b. et al. (2007). Aluminium. Senyawa aluminium lainnya. Dalam Buku Pegangan tentang Toksikologi Logam (Edisi Ketiga). Pulih dari scientedirect.com.
- Gupta, r.C. dan Crissman, J.W. (2013). Penilaian Keselamatan Termasuk Masalah Saat Ini dan Muncul dalam Patologi Toksikologi. Risiko manusia. Dalam Haschek dan Buku Pegangan Patologi Toksikologi (Edisi Ketiga). Pulih dari scientedirect.com.
- Putih, w.DAN. dan Bushey, untuk.H. (1944). Aluminium Phhosphide - Persiapan dan Komposisi. Jurnal American Chemical Society 1944, 66, 10, 1666-1672. Pulih dari pub.ACS.org.
- Mirzaei, Maryam dan Mirzaei, Mahmoud. (2011). Sebuah studi teoritis nanotube aluminium fosfida boron-due. Kimia Komputasi dan Teoritis 963 (2011) 294-297. Pulih dari scientedirect.com.
- Takahashi, l. Dan Takahashi, k. (2018). Menyetel struktur elektronik nanotube aluminium fosfida ini. ACS Appl. Nano Mater. 2018, 1, 501-504. Pulih dari pub.ACS.org.
- Gupta, hlm.K. (2016). Efek toksik pesisida (agrokimia). Aluminium fosfida. Dalam dana toksikologi. Pulih dari scientedirect.com.
- « Koordinat persegi panjang contoh dan latihan diselesaikan
- Tingkat polinomial bagaimana hal itu ditentukan, contoh dan latihan »

