Karakteristik Model Atom Thomson, Deposulat, Partikel Subatomik
- 4840
- 152
- Jessie Harvey
Dia Model Atom Thomson Itu dibuat oleh fisik bahasa Inggris yang dirayakan j. J. Thomson, yang menemukan elektron. Karena penemuan ini dan karya -karyanya tentang konduksi listrik dalam gas, itu diberikan pada tahun 1906 dengan Hadiah Nobel dalam Fisika.
Dari karyanya dengan sinar katoda, terungkap bahwa atom itu bukan entitas yang tak terpisahkan, seperti yang Dalton mendalilkan dalam model sebelumnya, tetapi itu berisi struktur internal yang ditentukan dengan baik.

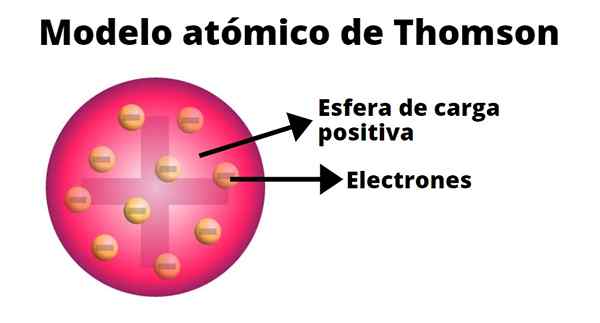
Thomson mengembangkan model atom berdasarkan hasil eksperimennya dengan sinar katoda. Di dalam dirinya dia menegaskan bahwa atom, netral secara listrik, terbentuk dari muatan positif dan negatif dengan besarnya.
[TOC]
Apa nama model atom Thomson dan mengapa?
Menurut Thomson, beban positif didistribusikan ke seluruh atom dan muatan negatif tertanam di dalamnya seolah -olah mereka adalah kismis puding. Dari perbandingan ini istilah "kismis puding" muncul, karena model tersebut diketahui secara informal.
 Joseph John Thomson
Joseph John Thomson Sementara ide Thomson saat ini cukup primitif, untuk waktunya ia mewakili kontribusi baru. Selama validitas singkat model (dari tahun 1904 hingga 1910), ia mendapat dukungan dari banyak ilmuwan, meskipun banyak orang lain menganggapnya sebagai bid'ah.
Akhirnya pada tahun 1910 bukti baru muncul tentang struktur atom dan model Thomson dengan cepat tetap tersingkir. Ini terjadi segera setelah Rutherford menerbitkan hasil eksperimen dispersi, yang menunjukkan adanya nukleus atom.
Namun, model Thomson adalah yang pertama mendalilkan keberadaan partikel subatomik dan hasilnya adalah buah dari eksperimen yang bagus dan ketat. Dengan cara ini ia menetapkan preseden untuk semua penemuan yang mengikuti.
Karakteristik dan Deposulat Model Thomson
Thomson tiba di model atomnya berdasarkan beberapa pengamatan. Yang pertama adalah bahwa X -rays yang baru ditemukan oleh Roentgen mampu mengionisasi molekul udara. Sampai saat itu, satu -satunya cara untuk mengionisasi adalah memisahkan ion secara kimia menjadi larutan.
Tetapi fisikawan Inggris berhasil mengionisasi bahkan gas monoatomik seperti helium, melalui x -rays. Ini membuatnya percaya bahwa beban di dalam atom dapat dipisahkan, dan karena itu tidak dapat dibagi.Dia juga mengamati bahwa sinar katoda dapat dialihkan oleh medan listrik dan magnet.
 J.J. Thomson, penemu elektron. Sumber: Lafer.
J.J. Thomson, penemu elektron. Sumber: Lafer. Kemudian Thomson merancang model yang dengan benar menjelaskan fakta bahwa atom netral secara elektrik dan bahwa sinar katoda terdiri dari partikel dengan beban negatif.
Survei Bukti Eksperimental, Thomson menandai atom sebagai berikut:
-Atom adalah bola padat netral elektrik, dengan radius perkiraan 10-10 M.
-Beban positif didistribusikan lebih atau kurang seragam oleh bola.
-Atom berisi "sel -sel" dimuat secara negatif, yang memastikan netralitasnya.
-Sel -sel ini sama untuk semua materi.
-Saat atom seimbang, ada N sel lainnya diatur secara teratur dalam cincin dalam bidang beban positif.
-Massa atom didistribusikan secara seragam.
Sinar katoda
 Balok elektron diarahkan dari katoda ke anoda.
Balok elektron diarahkan dari katoda ke anoda. Thomson melakukan eksperimennya menggunakan sinar katoda, ditemukan pada tahun 1859. Sinar katoda adalah partikel bermuatan negatif. Untuk memproduksinya, tabung kristal vakum digunakan, di mana dua elektroda ditempatkan, disebut katoda Dan anoda.
Dapat melayani Anda: Magnetisme: sifat magnetik bahan, penggunaanKemudian arus listrik dilewatkan yang memanaskan katoda, yang dengan demikian memancarkan radiasi yang tidak terlihat yang diarahkan langsung ke elektroda yang berlawanan.
Untuk mendeteksi radiasi, yang tidak lain adalah sinar katoda, dinding tabung ditutupi dengan bahan fluoresen. Saat radiasi datang ke sana, dinding tabung mengeluarkan luminositas yang intens.
Jika objek padat diselingi di jalur sinar katoda, ia melempar bayangan di dinding tabung. Ini menunjukkan bahwa sinar bergerak dalam garis lurus, dan juga bahwa mereka dapat dengan mudah memblokirnya.
Sifat sinar katoda banyak dibahas, karena sifatnya tidak diketahui. Beberapa mengira mereka adalah gelombang elektromagnetik, sementara yang lain berpendapat bahwa mereka adalah partikel.
Partikel subatomik dari Model Atom Thomson
Model atom Thomson adalah, seperti yang kami katakan, yang pertama mendalilkan keberadaan partikel subatomik. Tikus Thomson tidak lain adalah elektron, partikel -partikel mendasar dari atom yang dimuat secara negatif.
Kami saat ini tahu bahwa dua partikel mendasar lainnya adalah proton, dimuat secara positif, dan neutron tanpa beban.
Tetapi ini tidak ditemukan pada saat Thomson menguraikan modelnya. Muatan positif dalam atom didistribusikan di dalamnya, tidak mempertimbangkan partikel yang membawa beban tersebut dan saat ini tidak ada bukti keberadaannya.
Untuk alasan ini, modelnya memiliki keberadaan singkat, karena selama beberapa tahun, eksperimen dispersi Rutherford membuka jalan bagi penemuan proton. Dan untuk neutron, Rutherford sendiri mengusulkan keberadaannya beberapa tahun sebelum akhirnya ditemukan.
Tabung Crookes
Sir William Crookes (1832-1919) merancang tabung yang menyandang namanya sekitar tahun 1870, dengan maksud dengan cermat mempelajari sifat sinar katoda dengan hati-hati. Dia menambahkan medan listrik dan medan magnet, dan mengamati bahwa sinar itu dialihkan oleh ini.
 Skema Tabung Ray Katode. Sumber: Knight, R.
Skema Tabung Ray Katode. Sumber: Knight, R. Dengan cara ini, Crookes dan peneliti lain, termasuk Thomson, menemukan bahwa:
- Arus listrik dihasilkan di dalam tabung sinar katoda
- Sinar -sinar itu menyimpang oleh adanya medan magnet, dengan cara yang sama seperti partikel bermuatan negatif.
- Logam apa pun yang digunakan untuk memproduksi katoda sama baiknya untuk memproduksi sinar katoda, dan perilakunya tidak tergantung pada bahannya.
Pengamatan ini memicu diskusi seputar asal -usul sinar katoda. Mereka yang berpendapat bahwa mereka adalah gelombang didasarkan pada fakta bahwa sinar katoda dapat melakukan perjalanan dalam garis lurus. Selain itu, hipotesis ini menjelaskan dengan sangat baik bayangan bahwa benda padat yang diselingi dilemparkan ke dinding tabung dan dalam keadaan tertentu, diketahui bahwa gelombang dapat menyebabkan fluoresensi.
Tetapi sebaliknya tidak dipahami bagaimana mungkin bahwa medan magnet mengalihkan sinar katoda. Ini hanya memiliki penjelasan jika sinar ini dianggap sebagai partikel, hipotesis yang dibagikan Thomson.
Partikel dimuat dalam medan listrik dan magnet yang seragam
Sebuah partikel yang dimuat dengan beban Q, mengalami kekuatan iman di tengah medan listrik yang seragam dan, besarnya:
Dapat melayani Anda: teori cahaya bergelombang: penjelasan, aplikasi, contohIman = qe
Ketika partikel yang dimuat secara tegak lurus melintasi medan listrik yang seragam, seperti yang terjadi antara dua pelat dengan beban yang berlawanan, ia mengalami penyimpangan, dan karenanya akselerasi:
qe = ma
a = qe/m
Di sisi lain, jika partikel yang dimuat bergerak dengan kecepatan V besarnya, di tengah medan magnet yang seragam BESAR B, gaya magnet FM yang mengalami intensitas berikut:
FM = QVB
Selama kecepatan dan vektor medan magnet tegak lurus. Ketika partikel yang dimuat mempengaruhi tegak lurus dalam medan magnet yang homogen, ia juga mengalami penyimpangan dan gerakannya seragam melingkar.
Percepatan sentripetal keC Dalam hal ini adalah:
QVB = MAC
Pada gilirannya, akselerasi sentripetal terkait dengan kecepatan partikel V dan jari -jari R lintasan melingkar:
keC = v2/R
Karena itu:
QVB = MV2/R
Jari -jari lintasan melingkar dapat dihitung sebagai berikut:
R = MV/QB
Nanti persamaan ini akan digunakan untuk menciptakan kembali cara Thomson menyimpulkan rasio beban elektron.
Eksperimen Thomson
Thomson melewati seberkas sinar katoda, sinar elektron, meskipun dia masih belum tahu, melalui medan listrik yang seragam. Bidang -bidang ini dibuat antara dua pelat konduktif yang dimuat dan dipisahkan pada jarak yang kecil.
Sinar katoda juga melewati medan magnet yang seragam, mengamati efek yang dimiliki pada balok. Baik dalam satu bidang dan yang lain, ada defleksi di Sinar, yang membuat Thomson berpikir, dengan benar, bahwa balok itu terdiri dari partikel bermuatan.
Untuk memeriksa, Thomson melakukan beberapa strategi dengan sinar katoda:
- Variasi medan listrik dan magnet sampai kekuatan dibatalkan. Dengan cara ini, sinar katoda dilewati tanpa percobaan defleksi. Pencocokan kekuatan listrik dan magnetik, Thomson berhasil menentukan kecepatan partikel balok.
- Membatalkan intensitas medan listrik, dengan cara ini partikel mengikuti lintasan melingkar di tengah medan magnet.
- Menggabungkan hasil langkah 1 dan 2 untuk menentukan rasio beban-mandy dari "sel lainnya".
Rasio massa kargo elektron
Thomson menetapkan bahwa rasio kargo-mandy dari partikel yang membentuk sinar sinar katoda memiliki nilai berikut:
Q/M = 1.758820 x 10 11 c.kg-1.
Di mana q mewakili beban "sel darah", yang sebenarnya adalah elektron dan M Itu adalah massa yang sama. Thomson mengikuti prosedur yang dijelaskan di bagian sebelumnya, yang kami buat ulang di sini langkah demi langkah, dengan persamaan yang ia gunakan.
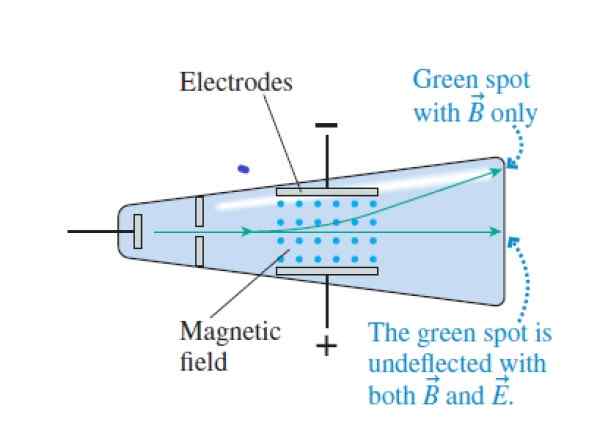 Saat sinar katoda melintasi salib dan medan magnet melintasi, mereka lulus tanpa defleksi. Ketika medan listrik dibatalkan, mereka mempengaruhi bagian atas tabung (medan magnet ditunjukkan dengan titik biru antara elektroda). Sumber: Knight, R.
Saat sinar katoda melintasi salib dan medan magnet melintasi, mereka lulus tanpa defleksi. Ketika medan listrik dibatalkan, mereka mempengaruhi bagian atas tabung (medan magnet ditunjukkan dengan titik biru antara elektroda). Sumber: Knight, R. Langkah 1
Cocokkan gaya listrik dan gaya magnet, melewati balok melalui medan listrik dan magnet tegak lurus:
QVB = QE
Langkah 2
Tentukan kecepatan yang diperoleh oleh partikel balok ketika mereka lulus langsung tanpa defleksi:
V = E/B
Langkah 3
Batalkan medan listrik, hanya menyisakan medan magnet (sekarang ada defleksi):
R = MV/QB
Dengan hasil v = e/b:
R = me/qb2
Jari -jari orbit dapat diukur, oleh karena itu:
Q/M = V/RB
O Nah:
Q/M = E/RB2
Langkah selanjutnya
Hal berikutnya yang dilakukan Thomson adalah mengukur q/m quotient menggunakan katoda yang terbuat dari bahan yang berbeda. Seperti yang dinyatakan di atas, semua logam memancarkan sinar katoda dengan karakteristik yang identik.
Dapat melayani Anda: reaktansi induktifKemudian Thomson membandingkan nilainya dengan rasio q/m dari ion hidrogen, diperoleh dengan elektrolisis dan nilainya sekitar 1 x 108 C/kg. Kosien masa beban elektron sekitar 1750 kali lebih besar dari ion hidrogen.
Oleh karena itu sinar katoda memiliki beban yang jauh lebih besar, atau mungkin massa jauh lebih kecil dari ion hidrogen. Ion hidrogen hanyalah sebuah proton, yang keberadaannya diketahui waktu setelah percobaan dispersi Rutherford.
Hari ini diketahui bahwa proton hampir 1800 kali lebih masif daripada elektron dan dengan beban dengan magnitudo yang sama dan menandatangani bertentangan dengan elektron.
Detail penting lainnya adalah bahwa dengan eksperimen Thomson, muatan listrik elektron tidak ditentukan, atau nilai massa secara terpisah. Nilai -nilai ini ditentukan melalui percobaan Millikan, yang dimulai pada tahun 1906.
Perbedaan Model Thomson dan Dalton
Perbedaan mendasar dari kedua model ini adalah bahwa Dalton berpikir bahwa atom adalah sebuah bola. Berlawanan dengan Thomson, dia tidak mengusulkan keberadaan tuduhan positif atau negatif. Untuk Dalton, atom seperti ini:
 Atom Dalton
Atom Dalton Seperti yang telah kita lihat sebelumnya, Thomson berpikir bahwa atom itu dapat dibagi, dan yang strukturnya dibentuk oleh bola positif dan elektron di sekitar.
Kegagalan dan Keterbatasan Model
Pada saat itu, model atom Thomson berhasil menjelaskan perilaku kimia zat dengan sangat baik. Dia juga dengan tepat menjelaskan fenomena yang terjadi di tabung sinar katoda.
Tetapi sebenarnya Thomson bahkan tidak menyebut partikel "elektron" -nya, meskipun istilah itu sebelumnya telah diciptakan oleh George Johnstone Stoney. Thomson hanya menyebut mereka "sel lainnya".
Meskipun Thomson memanfaatkan semua pengetahuan yang dia miliki untuk saat ini, ada beberapa batasan penting dalam modelnya, yang segera terbukti:
-Beban positif tidak didistribusikan ke seluruh atom. Eksperimen dispersi Rutherford menunjukkan bahwa beban positif atom harus terbatas pada wilayah kecilnya, yang kemudian dikenal sebagai nukleus atom.
-Elektron memiliki distribusi spesifik dalam setiap atom. Elektron tidak didistribusikan secara seragam, seperti kismis Buddine yang terkenal, tetapi memiliki disposisi dalam orbital yang ditunjukkan oleh model selanjutnya.
Justru disposisi elektron dalam atom yang memungkinkan pengorganisasian elemen untuk karakteristik dan sifatnya dalam tabel periodik. Ini adalah batasan penting dari model Thomson, yang tidak dapat menjelaskan bagaimana mungkin untuk memesan elemen dengan cara ini.
-Inti atom adalah yang mengandung sebagian besar adonan. Model Thomson mendalilkan bahwa massa atom didistribusikan secara seragam di dalam. Tetapi hari ini kita tahu bahwa massa atom secara praktis terkonsentrasi dalam proton dan neutron nukleus.
Penting juga untuk menyoroti bahwa model atom ini tidak memungkinkan menyimpulkan jenis gerakan yang dimiliki elektron dalam atom.
Artikel yang menarik
Model Atom Schrödinger.
Model Atom Broglie.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Demokritus.
Model Atom Leucipo.
Model Atom Bohr.
Model Atom Sommerfeld.
Model atom saat ini.
Referensi
- Andriessen, m. 2001. Kursus HSC. Fisika 2. Jacaranda HSC Science.
- Arfken, g. 1984. Fisika Universitas. Pers Akademik.
- Knight, r. 2017. Fisika untuk Ilmuwan dan Teknik: Pendekatan Strategi. Pearson.
- Rex, a. 2011. Dasar -dasar fisika. Pearson.
- Wikipedia. Model Atom Thomson. Pulih dari: itu.Wikipedia.org.
- « Persamaan Kuadrat Rumus Umum, Contoh, Latihan
- Model Aomic Karakteristik Dirac Jordan dan Deposulat »

