Model mekanik kuantum atom

- 5063
- 1630
- Miss Wm Hudson
Apa model mekanik kuantum atom?
Dia Model mekanik kuantum atom Ini mengandaikan bahwa ini dibentuk oleh inti pusat yang dibentuk oleh proton dan neutron. Elektron, dari beban negatif, membungkus nukleus di daerah difus yang dikenal sebagai orbital.
Bentuk dan perpanjangan orbital elektronik ditentukan oleh beberapa besaran: potensi inti dan kadar energi dan momentum sudut elektron yang kuantisasi.
 Gambar 1. Model atom helium menurut mekanika kuantum. Ini terdiri dari awan probabilitas dari dua elektron helium yang mengelilingi nukleus positif 100 ribu kali lebih kecil. Sumber: Wikimedia Commons.
Gambar 1. Model atom helium menurut mekanika kuantum. Ini terdiri dari awan probabilitas dari dua elektron helium yang mengelilingi nukleus positif 100 ribu kali lebih kecil. Sumber: Wikimedia Commons. Menurut mekanika kuantum, elektron memiliki perilaku dua partikel gelombang dan skala atom difus dan tidak spesifik. Dimensi atom secara praktis ditentukan oleh perluasan orbital elektronik yang mengelilingi nukleus positif.
Gambar 1 menunjukkan struktur atom helium, yang memiliki inti dengan dua proton dan dua neutron. Nukleus ini dikelilingi oleh awan probabilitas dua elektron yang mengelilingi nukleus, yang seratus ribu kali lebih kecil. Pada gambar berikut Anda dapat melihat atom helium, dengan proton dan neutron di dalam nukleus dan elektron dalam orbital.

Ukuran atom helium adalah urutan a Angstrom (1 Å), yaitu 1 x 10^-10 m. Sedangkan ukuran nukleusnya adalah dari urutan a femtometer (1 fm), yaitu 1 x 10^-15 m.
Meskipun sangat kecil secara komparatif, 99,9% dari berat atom terkonsentrasi pada nukleus kecil. Ini karena proton dan neutron 2.000 kali lebih berat dari elektron yang mengelilinginya.
Dapat melayani Anda: 31 jenis kekuatan dalam fisika dan karakteristiknyaSkala atom dan perilaku kuantum
Salah satu konsep yang memiliki pengaruh paling besar pada pengembangan model atom adalah dualitas Gelombang - Partikel: Penemuan bahwa setiap objek materi memiliki gelombang materi yang terkait.
Rumus yang memungkinkan panjang gelombang dihitung λ Terkait dengan objek material diusulkan oleh Louis de Broglie pada tahun 1924 dan sebagai berikut:
λ = h / (m v)
Di mana H Itu konstan Planck, M adonan dan v kecepatan.
Menurut prinsip de Broglie, setiap objek memiliki perilaku ganda, tetapi tergantung pada skala interaksi, kecepatan dan massa, perilaku gelombang bisa lebih unggul daripada partikel atau sebaliknya.
Elektronnya ringan, massanya adalah 9,1 × 10^-31 kg. Kecepatan khas elektron adalah 6000 km/s (lima puluh kali lebih sedikit dari kecepatan cahaya). Kecepatan ini sesuai dengan nilai energi dalam kisaran lusinan elektron-voltio.
Dengan data sebelumnya, dan dengan menggunakan rumus De Broglie, panjang gelombang untuk elektron dapat diperoleh:
λ = 6.6 x 10^-34 j s / (9.1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektron ke energi khas dari tingkat atom, memiliki panjang gelombang dengan urutan besarnya dengan skala atom, sehingga pada skala itu memiliki perilaku ondulatory dan bukan partikel.
Model kuantum pertama
Dengan ide dalam pikiran bahwa elektron skala atom memiliki perilaku bergelombang, model atom pertama berdasarkan prinsip -prinsip kuantum dikembangkan. Di antara ini, model atom Bohr menonjol, yang dengan sempurna memperkirakan spektrum emisi hidrogen, tetapi tidak pada atom lainnya.
Dapat melayani Anda: upaya ketegangan: formula dan persamaan, perhitungan, latihanModel Bohr dan selanjutnya dari Sommerfeld, adalah model semi-klasik. Artinya, elektron adalah sebagai partikel yang mengalami gaya tarik elektrostatik dari nukleus yang diorbit di sekitarnya, diatur oleh hukum kedua Newton.
Selain orbit klasik, model pertama ini memperhitungkan bahwa elektron memiliki gelombang material terkait. Hanya orbit yang perimeter yang merupakan bilangan bulat panjang gelombang diizinkan, karena mereka yang tidak memenuhi kriteria ini memudar oleh gangguan destruktif.
Maka kuantisasi energi dalam struktur atom muncul untuk pertama kalinya.
Kata kuantum Justru berasal dari fakta bahwa elektron hanya dapat mengambil beberapa nilai energi diskrit dalam atom. Ini bertepatan dengan temuan Planck, yang terdiri dari penemuan bahwa radiasi frekuensi F Berinteraksi dengan materi dalam paket energi E = h f, Di mana H Itu konstan Planck.
Bentuk dan ukuran orbital
Lingkup radial orbital ditentukan oleh fungsi gelombang radike. Lebih besar sejauh energi elektron tumbuh, yaitu, sejauh angka kuantum utama meningkat.
Jarak radial biasanya diukur dalam radio Bohr, yang untuk energi hidrogen terendah adalah 5,3 x 10-11 m = 0,53 Å.
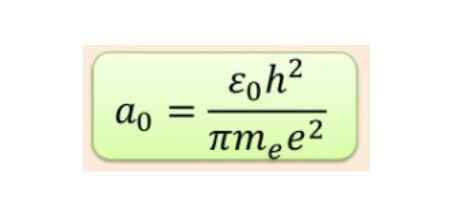 Gambar 2. Formula Radius Bohr. Sumber: f. Zapata.
Gambar 2. Formula Radius Bohr. Sumber: f. Zapata. Tetapi bentuk orbital ditentukan oleh nilai jumlah kuantum momentum sudut. Jika l = 0 Anda memiliki orbital bola yang disebut S, jika l = 1 Anda memiliki orbital lobed yang dipanggil P, yang dapat memiliki tiga orientasi sesuai dengan angka kuantum magnetik. Gambar berikut menunjukkan bentuk orbital.
Dapat melayani Anda: magnitudo vektor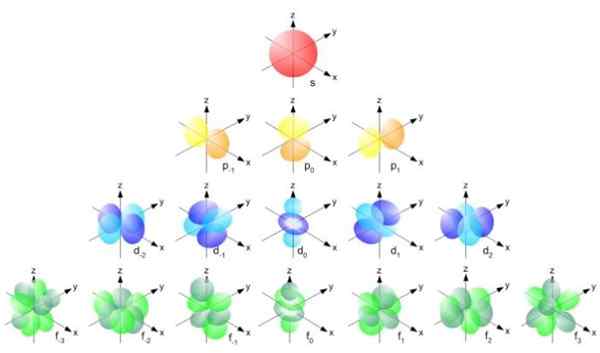 Gambar 3. Bentuk orbital s, p, d, f. Sumber: UCDAVIS Chemwiki.
Gambar 3. Bentuk orbital s, p, d, f. Sumber: UCDAVIS Chemwiki. Orbital -orbital ini dikemas di dalam orang lain sesuai dengan energi elektron. Misalnya, gambar berikut menunjukkan orbital dalam atom natrium.
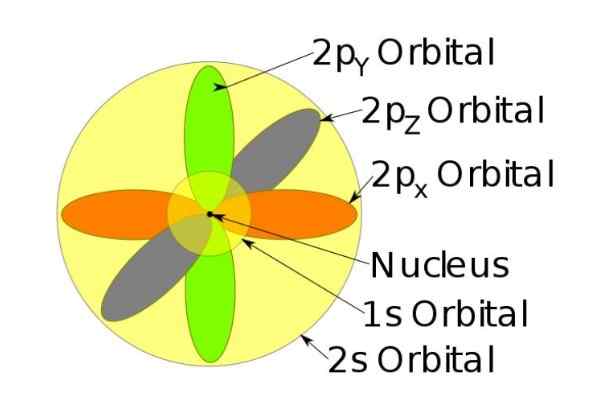 Gambar 4. Orbital 1s, 2s, 2p ion natrium saat telah kehilangan elektron. Sumber: Wikimedia Commons.
Gambar 4. Orbital 1s, 2s, 2p ion natrium saat telah kehilangan elektron. Sumber: Wikimedia Commons. Putarannya
Model mekanik kuantum dari persamaan Schrödinger tidak menggabungkan spin elektron. Tetapi Pauli diperhitungkan melalui prinsip eksklusi, yang menunjukkan bahwa orbital dapat mengisi hingga dua elektron dengan angka putaran kuantum s = +½ dan s = -½.
Misalnya, ion natrium memiliki 10 elektron, yaitu, jika kita merujuk pada gambar sebelumnya, ada dua elektron untuk setiap orbital.
Tetapi jika itu adalah atom natrium netral, ada 11 elektron, yang terakhir akan menempati orbital 3S (tidak ditunjukkan pada gambar dan jari -jari yang lebih besar dari 2s). Putaran atom sangat menentukan dalam karakteristik magnetik suatu zat.
Referensi
- Alonso - Finn. Kuantum dan yayasan statistik. Addison Wesley.
- Eisberg - Resnick. Fisika kuantum. Limusa - Wiley.
- Gasiorowicz. Fisika kuantum. John Wiley & Sons.
- HSC. Kursus Fisika 2. Jacaranda Plus.
- Wikipedia. Model atom Schrodinger. Pulih dari: wikipedia.com

