Model Atom
- 2644
- 819
- Joseph Nader PhD
 Model atom adalah representasi grafik yang berbeda yang telah diberikan kepada atom sepanjang sejarah. Shuttersock
Model atom adalah representasi grafik yang berbeda yang telah diberikan kepada atom sepanjang sejarah. Shuttersock Apa itu model atom?
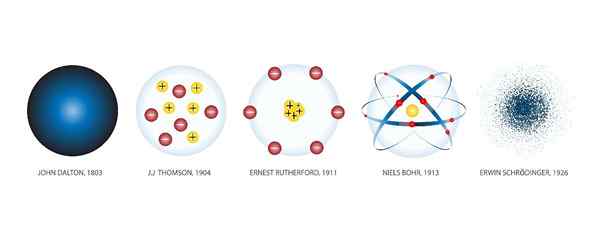
Itu Model Atom Mereka adalah representasi grafis dari struktur dan pengoperasian atom. Ada banyak model sepanjang sejarah.
Ini karena gagasan atom sebagai blok mendasar di mana materi dibuat, lahir ribuan tahun yang lalu, di Yunani kuno. Pada waktu itu atom hanyalah produk dari spekulasi filosofis.
Ketika penemuan ilmiah baru dibuat, model baru dibuat untuk menggabungkan pengetahuan yang diperoleh. Dan itu telah terjadi abad ke abad ke abad hingga hari ini, ketika teknologi telah memungkinkan kami untuk mengamati atom melalui mikroskop dan menentukan model yang benar.
Apa itu atom?
Atom -atomnya adalah struktur submikroskopis yang semua subjek yang kita rasakan terbentuk dan yang dengannya kita berinteraksi setiap hari, dari tubuh kita sendiri, makanan yang kita makan, pakaian yang kita kenakan, ke gedung pencakar langit dan pesawat terbang besar.
Juga, matahari, bulan, planet, bintang dan galaksi dibentuk dengan atom.
Ini sangat kecil sehingga tidak dapat dilihat dengan mikroskop umum. Lainnya dibutuhkan kekuatan yang lebih besar, yang disebut ultramicroscopes. Namun, atom bukan unit alam terkecil.
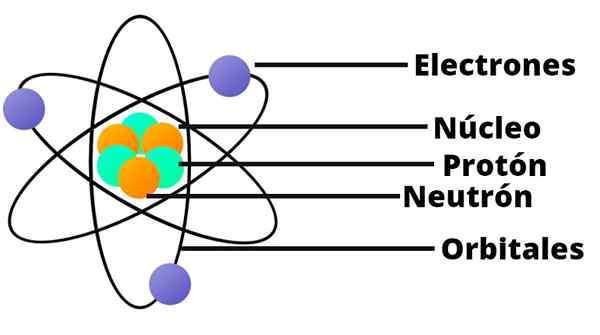
Atom dibentuk pada gilirannya oleh partikel yang lebih kecil: proton, neutron dan elektron.
Proton memiliki muatan listrik yang positif, sedangkan neutron tidak memiliki muatan listrik. Dua jenis partikel ini membentuk inti atom.
Berputar di sekitar nukleus seperti planet di sekitar matahari adalah elektron, yang memiliki muatan listrik negatif.
Model Atom Demokritus

Democritus of Abdera adalah seorang filsuf Yunani yang tinggal di antara 460 dan 370 sebelum era saat ini. Dia menegaskan bahwa semua materi dibentuk oleh partikel -partikel kecil yang dia sebut atom, yang dalam bahasa Yunani berarti tidak terpisahkan.
Menurut Democritus, atom adalah bagian terkecil di mana masalah tersebut dapat dibagi. Ada jumlah yang tak terbatas dari mereka, yang tidak bisa dihancurkan, luar biasa, abadi dan benar -benar kompak, tanpa pori -pori. Ada beberapa jenis, yang berbeda berdasarkan bentuk, besarnya, posisi dan cara mereka bersedia.
Itu dapat melayani Anda: bencana yang disebabkan oleh manusia saat menggunakan sains dan teknologiTeori demokritus ditolak oleh Aristoteles dan kemudian benar -benar dilupakan sampai munculnya sains modern.
Model Atom Dalton

John Dalton (1766-1844) adalah seorang ahli meteorologi bahasa Inggris yang tertarik untuk menyelidiki undang-undang yang mengatur perilaku gas. Buah karyanya di bidang itu adalah model atom pertama dari sains modern, yang ia buat pada tahun 1803.
Karena keberadaan proton dan elektron belum ditemukan, Dalton mengatakan, seperti demokritus, bahwa atom adalah bagian terkecil di mana materi dapat dibagi dan, oleh karena itu, dengan sendirinya, tidak dapat dibagi.
Menurut Dalton, atom solid dan memiliki bentuk bola, seperti bola baseball. Dalton mengilustrasikan ukiran teorinya di kayu, bersama dengan asistennya, lusinan bidang yang mewakili atom dari berbagai elemen kimia yang berbeda.
Model ini berlaku sampai penemuan elektron.
Model Atom Thomson
Fisikawan Inggris Joseph John Thomson (1865-1940) harus membuat salah satu penemuan terpenting dari sains modern: yaitu elektron.
Itu pada tahun 1897, di laboratorium Cavendish di University of Cambridge, di Inggris, di mana sebuah plakat masih memperingati penemuan besar.
Thompson dan asistennya memproyeksikan sinar katoda di medan listrik. Setelah kontak dengan lapangan, sinar menyimpang membentuk sudut lebar. Ini mengkonfirmasi bahwa sinar katoda memiliki muatan listrik negatif. Partikel bermuatan negatif menyebutnya elektron.
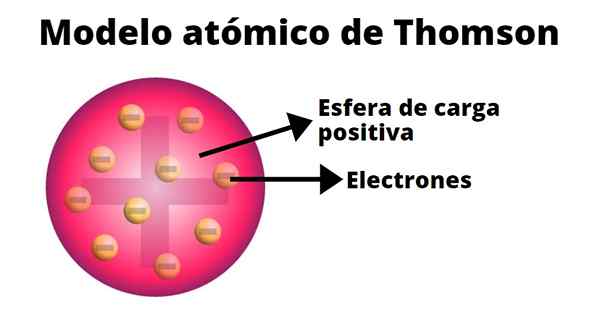
Thomson berasumsi bahwa elektron tertanam dalam atom. Model atomnya berasal dari tahun 1904.
Puding kismis
Dalam model atom Thompson, atom adalah bola padat dengan beban positif (proton) di mana neutron (beban negatif) didistribusikan secara acak, karena kismis dilemparkan ke pudin. Itulah sebabnya model ini dikenal sebagai "pudin de pasas".
Menurut Thompson, atom memiliki jari -jari 0,00000001 sentimeter dan bebannya netral, karena proton dan elektron memiliki beban yang sama, tetapi tanda yang berlawanan.
Model Thompson tidak menyajikan neutron.
Model Atom Rutherford
Ernest Rutherford (1871-1937), seorang ahli fisika Neozylean, adalah salah satu siswa Thomson yang paling terkemuka.
Dapat melayani Anda: penelitian korelasionalPada tahun 1911, dan berdasarkan penemuan radioaktivitas baru -baru ini, Rutherford melakukan percobaan berikut: Mereka menembakkan partikel radioaktif alfa dengan kecepatan tinggi dan energi terhadap selembar emas.
Jika model atom Thompson benar, partikel alfa akan melewati lembaran tanpa menyimpang atau dengan penyimpangan yang tidak signifikan. Namun, ketika mereka menghitung sudut penyimpangan dari partikel yang mereka temukan bahwa itu lebar, dan bahwa beberapa bahkan memantul terhadap lembaran emas.
Dengan hasil ini Rutherford mengerti bahwa atom harus memiliki inti yang sangat kecil dan sangat kental. Nukleus ini dituntut secara positif.
Tata Surya Kecil
Model atom Rutherford seperti tata surya miniatur. Di tengah, di tempat yang sesuai dengan matahari, ada inti dengan proton yang dimuat secara positif. Sekitar ini, mengorbit sebagai planet, ada elektron yang didistribusikan secara acak.
Rutherford juga menetapkan bahwa massa atom setara dengan jumlah massa elektron dan proton.
Model Atom Bohr
Meskipun model Rutherford adalah kemajuan yang tidak dapat disangkal sehubungan dengan model sebelumnya, itu memiliki cacat yang penting. Misalnya, jika elektron secara efektif orbital di sekitar nukleus mereka akan berakhir kehilangan energi dan runtuh pada nukleus. Tapi ini jelas tidak terjadi.
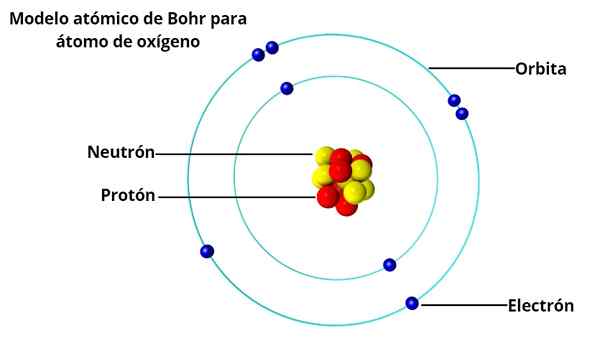
Fisikawan Denmark Niels Bohr (1885-1962), seorang mahasiswa Rutherford di University of Manchester (Inggris), yang akan mengusulkan pada tahun 1913 sebuah model atom yang memecahkan masalah yang ditimbulkan oleh profesor lamanya lamanyanya.
Orbit melingkar
Dalam model atom BOHR, elektron tidak mengorbit secara bebas di sekitar nukleus, tetapi lakukan dalam orbit melingkar yang stabil, dipisahkan satu sama lain dengan jarak tertentu, mirip dengan bagaimana planet -planet tata surya diatur. Setiap orbit disebut tingkat energi atau energi.
Berdasarkan investigasi Max Planck dan Albert Einstein, ia menentukan bahwa setiap elektron dalam orbit mereka memiliki sejumlah energi.
Saat mengorbit stabil di sekitar nukleus, dikatakan bahwa elektron berada dalam keadaan diam. Di sisi lain, ketika elektron "melompat" ke orbit energi yang lebih rendah, ada foton.
Dapat melayani Anda: metodologiNamun, model Bohr tidak berhasil menjelaskan operasi atom dengan lebih dari satu elektron.
Model Atom Sommerfeld
Arnold Sommerfeld (1868-1951) adalah seorang ahli fisika Jerman yang mendedikasikan karyanya untuk memperluas model atom Bohr. Model yang diperluas ini disajikan pada tahun 1916.
Berdasarkan teori relativitas Einstein, Sommerfeld menemukan bahwa beberapa elektron orbit di sekitar nukleus dengan kecepatan dekat cahaya (300.000 kilometer per detik).
Dia juga membuat modifikasi berikut pada model Bohr:
- Elektron bergerak di sekitar nukleus dalam orbit melingkar dan elips. Bohr hanya diakui orbit melingkar.
- Dalam tingkat energi yang sama ada sub -level dengan energi yang sedikit berbeda.
Model mekanik kuantum (Broglie, Heisenberg dan Schrödinger)
Ini adalah model atom paling akurat yang diketahui dan saat ini diterima, dengan beberapa tambahan berikutnya. Ini dikembangkan oleh tiga ilmuwan: Jerman Werner Heisenberg (1901-1976), Austria Erwin Schrödinger (1887-1961) dan Prancis Louis de Broglie (1892-1987).
Model ini membuang gagasan elektron yang mengorbit nukleus. Sebaliknya, kami memiliki awan elektronik, yang merupakan ruang di sekitar nukleus di mana dimungkinkan untuk menemukan elektron. Ini berperilaku seperti gelombang stasioner.
Probabilitas menemukan itu dihitung dengan persamaan yang ditetapkan oleh Schrödinger.
Ini adalah model mekanik kuantum atom yang dimulai dari persamaan Schrödinger. Dengan persamaan ini Anda dapat mengetahui probabilitas menemukan elektron pada titik tertentu dari sebuah atom.
Dalam model ini setiap elektron bergerak dalam arah tertentu, yang ditentukan oleh empat angka kuantum, yaitu: angka kuantum utama, angka kuantum sekunder, angka kuantum magnetik dan spin angka kuantum.
Tidak ada dua elektron yang memiliki angka kuantum yang identik, seperti yang dinyatakan oleh prinsip pengecualian yang ditemukan oleh fisikawan Wolfgang Pauli.
Referensi
- (2010). Atom. Encyclopedia Modern Inggris.
- (S. F.). Model Atom Demokritus, Atomisme Filsafat. Diambil dari nuklir energi.bersih.
- (S. F.). Sommerfeld Atomic Model, Ekspansi ke Model Bohr. Diambil dari nuklir energi.bersih.
- Bertsch, g. F.; Trefil, James dan McGrayne, Sharon Bertsch (2021). Atom. Encyclopedia Britannica. Diambil dari Britannica.com.
- Duignan, b. (2021). Demokritus. Encyclopedia Britannica. Diambil dari Britannica.com.
- Kontributor Ensiklopedia Dunia Baru. (2021). Atom. Diambil dari Newworldyclopedia.org.
- Zita, Ana. (S. F.). Model Atom. Diambil dari Todamatia.com.

