Struktur kimia barium nitrat, penggunaan, sifat

- 2578
- 748
- Frederick Pfeffer
Dia Barium nitrat Ini adalah garam yang terdiri dari atom barium (BA) dan ion nitrat (no3). Ini disajikan sebagai padatan kristal putih pada suhu kamar dan ada di alam sebagai mineral yang sangat langka yang dikenal sebagai nitrobarita. Sifatnya menjadikannya senyawa beracun yang harus dikelola dengan cermat.
Faktanya, senyawa ini memiliki banyak kegunaan dalam industri militer, karena dapat dikaitkan dengan zat kimia lainnya dan ditambahkan ke formulasi ledakan dan pembakar, antara lain.
 Penampilan Barium Nitrat. Sumber: w. Oelen/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0)
Penampilan Barium Nitrat. Sumber: w. Oelen/CC BY-SA (https: // createveCommons.Org/lisensi/by-sa/3.0) [TOC]
Rumus
Barium nitrat, juga disebut barium dyitrate, memiliki formula kimia BA (no3)2, dan biasanya diproduksi melalui dua metode.
Yang pertama melibatkan pembubaran potongan -potongan kecil barium karbonat (Bacchus3) Dalam medium medium -acidic (hno3, asam mineral yang sangat korosif), memungkinkan pengotor besi mengendap dan kemudian campuran ini disaring, diuapkan dan dikristalisasi.
Metode kedua dilakukan melalui kombinasi barium klorida (BACL2, Salah satu garam barium dari kelarutan yang lebih besar di dalam air) dengan larutan natrium nitrat yang sudah dipanaskan sebelumnya. Ini menghasilkan reaksi yang menghasilkan pemisahan kristal campuran barium nitrat.
Struktur kimia barium nitrat
Garam ini menyajikan karakteristik struktur kristal kubik atau octaedros anhidrat.
Struktur kimianya adalah sebagai berikut:
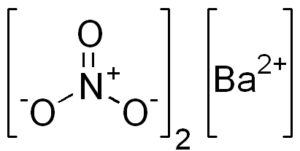
Disosiasi
Pada suhu tinggi (592 ºC), barium nitrat terurai untuk membentuk barium oksida (BAO), nitrogen dioksida (NO2) dan oksigen (atau2), Menurut reaksi kimia berikut:
Dapat melayani Anda: beryl hydroxide (be (OH) 2)2BA (no3)2 + Panas → 2BAO + 4no2 +SALAH SATU2
Dalam media dengan konsentrasi tinggi oksida nitrat (NO), dekomposisi barium nitrat menghasilkan senyawa yang disebut barium nitrit (BA (NO2)2), Sesuai dengan persamaan berikut:
Kamar mandi3)2 + 2No → BA (Tidak2)2 + 22
Reaksi dengan logam larut atau asam sulfat sulfat (H2Sw4) menghasilkan barium sulfat (baso4). Sebagian besar garam barium yang tidak larut, seperti karbonat (Bacchus3), Oksalat (BAC2SALAH SATU4) atau logam fosfat (BA3(PO4)2), diendapkan dengan reaksi dekomposisi ganda yang serupa.
Barium nitrate menggunakan
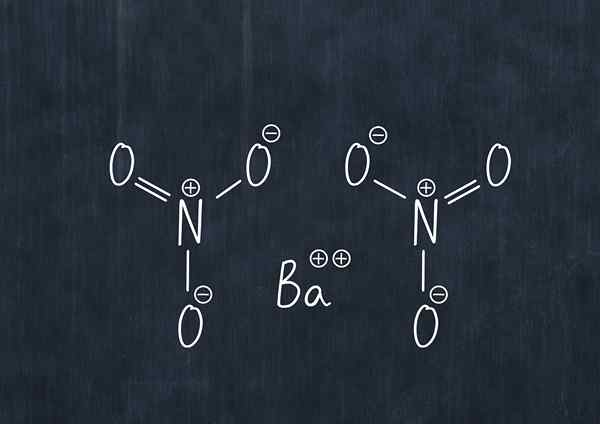 Formula kimia barium nitrat
Formula kimia barium nitrat Zat ini dalam debu adalah zat pengoksidasi dan bereaksi secara signifikan dengan agen pereduksi umum.
Ketika garam ini dicampur dengan logam lain, seperti aluminium atau seng dalam bentuknya yang terbagi halus, atau dengan paduan seperti aluminium-magn0esio, itu menyala dan mengeksploitasi dampaknya. Untuk alasan ini, barium nitrat dianggap sebagai komponen senjata dan bahan peledak militer yang sangat baik.
Bersama dengan trinitrotoluene (secara komersial dikenal sebagai TNT, atau C6H2(TIDAK2)3Ch3) dan pengikat (lilin parafin secara teratur), garam ini membentuk senyawa yang disebut Baratol, yang memiliki sifat eksplosif. Kepadatan tinggi barium nitrat menyebabkan Baratol juga memperoleh kepadatan yang lebih besar, membuatnya lebih efektif dalam fungsinya.
Barium nitrat juga bergabung dengan debu aluminium, formula yang menghasilkan pembentukan bubuk mesiu, yang digunakan terutama dalam kembang api dan piroteknik teater.
Flash ini juga telah melihat kegunaan dalam produksi flare (seperti pengukuran pesawat antimile) dan dalam granat yang terpana. Selain itu, zat ini sangat eksplosif.
Itu dapat melayani Anda: natrium sianida (NACN): struktur, sifat, risiko, penggunaanGaram ini dikombinasikan dengan campuran reaktan yang disebut termite untuk membentuk variasi dari titik yang disebut ini, yang menghasilkan kilatan pendek dan sangat kuat dari suhu tinggi di area kecil untuk waktu yang singkat.
Termate-th3 adalah istilah yang mengandung komposisi 29 % berdasarkan bobot barium nitrat, yang membantu meningkatkan efek termal, menghasilkan api dan secara signifikan mengurangi suhu pengapian dari termasi.
Theroots biasanya digunakan dalam produksi granat pembakar dan memiliki fungsi menghancurkan baju besi dan struktur tangki militer.
Selain itu, barium nitrat adalah salah satu bahan yang paling banyak digunakan dalam produksi tuduhan pembakar yang digunakan oleh Inggris dalam pesawat perang mereka selama Perang Dunia II, yang dipersenjatai dengan amunisi pembakar yang berfungsi untuk menghancurkan pesawat musuh.
Akhirnya, garam ini memiliki penggunaan dalam proses pembuatan barium oksida, dalam industri katup termionik dan, seperti yang telah dikatakan, dalam penciptaan piroteknik, terutama warna hijau.
Sifat fisik dan kimia
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Garam disajikan sebagai padatan putih, higroskopis dan toilet, yang sedikit larut dalam air dan benar -benar tidak larut dalam alkohol.
Ini memiliki massa molar 261.337 g/mol, kepadatan 3,24 g/cm3 dan titik fusi 592 ºC. Setelah mencapai titik mendidihnya, ia rusak, seperti yang telah dikatakan di atas. Pada suhu kamar, ia memiliki kelarutan air 10,5 g/100 ml.
Itu dianggap stabil, tetapi itu adalah agen pengoksidasi yang kuat dan harus jauh dari bahan yang mudah terbakar untuk menghindari api. Itu memiliki sensitivitas air dan tidak boleh dicampur dengan asam atau anhidrat.
Dapat melayani Anda: isoterm adsorpsi: konsep, jenis, contohDalam konsentrasi tinggi (misalnya, wadah) harus diisolasi dari zat yang dapat membuatnya bereaksi, karena dapat dieksploitasi dengan keras.
Seperti senyawa barium terlarut lainnya, ini adalah zat beracun untuk hewan dan manusia.
It should not be inhaled or consumed, since symptoms of poisoning (especially hardening of facial muscles), vomiting, diarrhea, abdominal pain, muscle tremors, anxiety, weakness, respiratory distress, cardiac irregularity and seizures and seizures.
Kematian dapat terjadi setelah keracunan dengan zat ini, beberapa jam atau beberapa hari setelah presentasi.
Penghirupan barium nitrat menghasilkan iritasi pada mukosa pernapasan dan, dalam kedua mode keracunan, larutan garam sulfat harus disiapkan untuk menerapkan pertolongan pertama pada yang terkena dampak.
Dalam hal tumpahan, itu harus diisolasi dari zat dan bahan yang mudah terbakar dan, dalam kasus api, Anda tidak boleh bersentuhan dengan bahan kimia atau busa kering. Area tersebut harus dibanjiri air jika api lebih besar.
Referensi
- Mabus. (S.F.). Sciencemadness. Diperoleh dari sciencemadness.org
- Bom Incenenier Amerika Serikat TH3-M50A3. (S.F.). Diperoleh dari amunitionpages.com
- Cameo Chemicals. (S.F.). Diperoleh dari cameochemical.NOAA.Pemerintah
- Chemspider. (S.F.). Diperoleh dari chemspider.com

