Rumus proses isobarik, persamaan, eksperimen, latihan

- 3639
- 909
- Ray Thiel
Di sebuah proses isobarik, tekanan P suatu sistem tetap konstan. Awalan "iso" berasal dari bahasa Yunani dan digunakan untuk menunjukkan bahwa sesuatu tetap konstan, sedangkan "baros", juga dari bahasa Yunani, berarti berat badan.
Proses isobarik sangat baik dalam wadah tertutup maupun di ruang terbuka, mudah untuk menemukannya di alam. Maksud kami, perubahan fisik dan kimia dimungkinkan pada permukaan duniawi atau reaksi kimia dalam wadah terbuka ke atmosfer.
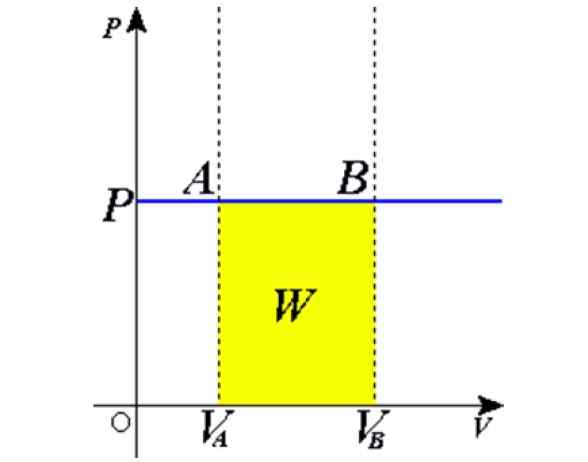 Gambar 1. Proses isobarik: Garis horizontal biru adalah isobara, yang berarti tekanan konstan. Sumber: Wikimedia Commons.
Gambar 1. Proses isobarik: Garis horizontal biru adalah isobara, yang berarti tekanan konstan. Sumber: Wikimedia Commons. Beberapa contoh diperoleh dengan memanaskan ke matahari sebuah balon penuh udara, memasak, mendidih atau air beku, uap yang dihasilkan dalam boiler atau proses mengangkat balon udara panas. Nanti kami akan memberikan penjelasan tentang kasus -kasus ini.
[TOC]
Formula dan Persamaan
Kami memperoleh persamaan untuk proses isobarik dengan asumsi bahwa sistem yang diteliti adalah gas yang ideal, model yang cukup cocok untuk hampir semua gas di kurang dari 3 atmosfer tekanan. Partikel gas ideal bergerak secara acak, menempati seluruh volume ruang yang mengandungnya tanpa berinteraksi satu sama lain.
Jika gas ideal terkunci dalam silinder yang disediakan dengan piston bergerak diizinkan untuk mengembang secara perlahan, dapat diasumsikan bahwa setiap saat partikelnya seimbang. Kemudian gas memberikan piston area KE kekuatan F Besarnya:
F = p.KE
Di mana P Itu adalah tekanan gas. Kekuatan ini memberikan pekerjaan yang menghasilkan perpindahan yang sangat kecil Dx Di piston yang diberikan oleh:
dw = fdx = pa.Dx
Seperti produknya ADX Ini adalah perbedaan volume Dv, Jadi DW = PDV. Tetap untuk mengintegrasikan kedua sisi dari volume awal VKE Sampai volume akhir VB Untuk mendapatkan total pekerjaan yang dilakukan oleh gas:


[TOC]
Eksperimen
Situasi yang dijelaskan diverifikasi secara eksperimental mengkonfigurasi gas dalam silinder yang dilengkapi dengan piston bergerak, seperti yang ditunjukkan pada Gambar 2 dan 3. Piston ditempatkan di piston, yang beratnya diarahkan ke bawah, sedangkan gas memberikan kekuatan berkat tekanan P yang dihasilkan pada piston.
Itu dapat melayani Anda: imantation: apa yang terdiri dari, metode, dan contoh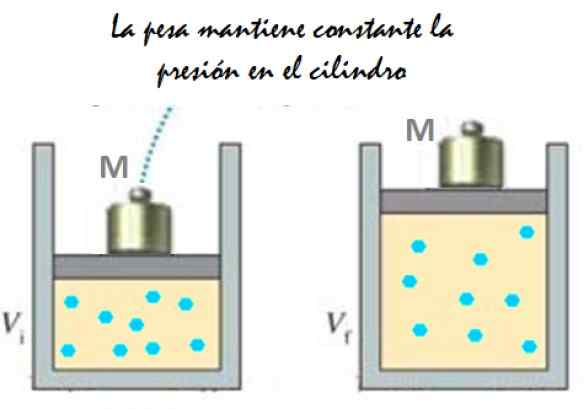 Gambar 2. Percobaan yang terdiri dari memperluas gas tekanan konstan. Sumber: f. Zapata.
Gambar 2. Percobaan yang terdiri dari memperluas gas tekanan konstan. Sumber: f. Zapata. Karena piston mampu bergerak bebas, volume yang ditempati gas dapat berubah tanpa masalah, tetapi tekanannya tetap konstan. Menambahkan tekanan atmosfer pATM, Itu juga memberikan kekuatan ke bawah, Anda memiliki:
Mg - p.A + pATM . A = konstan
Oleh karena itu: p = (mg/a) + pATM Itu tidak bervariasi, kecuali m dan dengan itu berat dimodifikasi. Menambahkan panas ke silinder, gas akan memperluas meningkatkan volumenya atau akan berkontraksi saat mengekstraksi panas.
Proses isobarik dalam gas ideal
Persamaan status gas ideal menghubungkan variabel penting: tekanan p, volume V dan suhu T:
P.V = n .R.T
Di sini N mewakili jumlah mol dan r adalah konstanta gas ideal (berlaku untuk semua gas), yang dihitung dengan mengalikan konstanta Boltzmann dengan bilangan avogadro, menghasilkan:
R = 8.31 j/mol k
Ketika tekanan konstan, persamaan keadaan dapat ditulis sebagai:
V/t = nr/p
Tetapi nr/p konstan, karena n, r dan p adalah. Jadi ketika sistem berpindah dari satu negara ke negara lain ke negara lain, proporsi berikut muncul, juga dikenal sebagai Hukum Charles:
V1/T1 = V2/T2
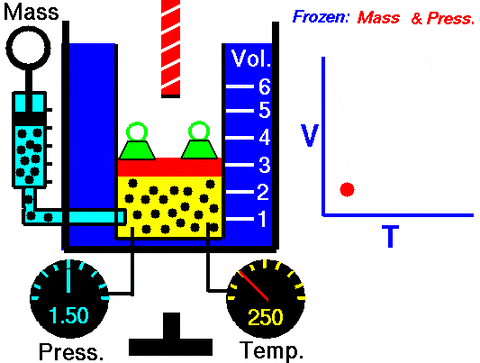 Gambar 3. Animasi yang menunjukkan perluasan gas tekanan konstan. Di sebelah kanan grafik volume tergantung pada suhu, yang merupakan garis. Sumber: Wikimedia Commons. Pusat Penelitian Glenn NASA [Domain Publik].
Gambar 3. Animasi yang menunjukkan perluasan gas tekanan konstan. Di sebelah kanan grafik volume tergantung pada suhu, yang merupakan garis. Sumber: Wikimedia Commons. Pusat Penelitian Glenn NASA [Domain Publik]. Menggantikan W = pΔV, Pekerjaan yang dilakukan untuk beralih dari keadaan 1 ke 2, dalam hal konstanta dan variasi suhu, mudah diukur dengan termometer:
W1 → 2 = nr (t2 - T1) = nr.Δt
Di sisi lain, hukum termodinamika pertama menetapkan bahwa:
∆U = q - w
Ini berarti bahwa menambah gas sejumlah panas Q, energi internal ∆U meningkat dan getaran molekulnya meningkat. Dengan cara ini, gas memperluas dan melakukan pekerjaan dengan menggusur piston, seperti yang telah kami katakan sebelumnya.
Dalam gas monoatomik yang ideal dan variasi energi internal ∆U, yang mencakup energi kinetik dan energi potensial molekulnya, adalah: adalah: adalah: adalah: adalah: adalah: adalah: adalah: adalah: adalah: adalah:
∆U = (3/2)Nr Δt
Akhirnya kami menggabungkan dalam satu ekspresi yang telah kami peroleh:
Q = ∆U + w = (3/2)Nr Δt + Nr∆t = (5/2) Nr Δt
Atau yang dapat ditulis ulang dalam hal massa M, perbedaan suhu dan konstanta baru yang disebut Panas panas spesifik pada tekanan konstan, disingkat CP, yang unitnya adalah J/Mol K:
Dapat melayani Anda: Venus (planet)Q = m cP ∆t
Contoh
Tidak semua proses isobarik dilakukan dalam wadah tertutup. Faktanya, proses termodinamika yang tak terhitung banyaknya dari semua jenis tekanan atmosfer terjadi, sehingga proses isobarik sangat sering terjadi. Ini termasuk perubahan fisik dan kimia di permukaan bumi, reaksi kimia dalam wadah terbuka dan banyak lagi.
Agar proses isobarik terjadi dalam sistem tertutup, perlu bahwa perbatasannya cukup fleksibel untuk memungkinkan perubahan volume tanpa tekanan bervariasi.
Inilah yang terjadi dalam percobaan piston yang mudah dipindahkan saat gas diperluas. Hal yang sama terjadi dengan melampirkan gas di pesta untuk pesta atau balon udara panas.
Di sini kami memiliki beberapa contoh proses isobarik:
Rebus air dan masak
Air mendidih untuk teh atau saus memasak dalam wadah terbuka adalah contoh yang baik dari proses isobarik, karena semua orang berkembang dengan tekanan atmosfer.
Saat memanaskan air, suhu dan volume meningkat dan jika panas dilanjutkan, titik didih akhirnya tercapai, di mana perubahan fase air terjadi. Sementara ini terjadi, suhu juga tetap konstan 100 º C.
Air beku
Di sisi lain, air beku juga merupakan proses isobarik, apakah itu terjadi di danau selama musim dingin atau kulkas domestik.
Panaskan balon penuh udara hingga matahari
Contoh lain dari proses isobarik adalah perubahan volume balon yang meningkat udara ketika dibiarkan terpapar matahari. Hal pertama di pagi hari, ketika tidak terlalu panas, dunia memiliki volume tertentu.
Seiring berjalannya waktu dan suhu meningkat, dunia juga memanas meningkatkan volume dan semua ini terjadi di bawah tekanan konstan. Bahan Globe adalah contoh yang baik dari perbatasan yang cukup fleksibel untuk membuat udara di dalam, saat dipanaskan, mengembang tanpa memodifikasi tekanan.
Pengalaman itu juga dapat dilakukan dengan menyesuaikan dunia tanpa membakar di puncak botol kaca penuh dengan sepertiga air, yang dipanaskan ke Maria Bio dari Mary. Segera setelah air dipanaskan, balon segera meningkat, tetapi perawatan harus diambil untuk tidak memanaskan terlalu banyak sehingga tidak meledak.
Balon aerostatik
Ini adalah kapal mengambang tanpa penggerak, yang memanfaatkan arus udara untuk mengangkut orang dan benda. Dunia biasanya dipenuhi dengan udara panas, yang lebih dingin dari udara di sekitarnya, naik dan mengembang membuat dunia kasar.
Dapat melayani Anda: triple pointSaat arus udara langsung ke dunia, ia memiliki pembakar yang diaktifkan untuk memanaskan gas saat Anda ingin naik atau mempertahankan ketinggian, dan dinonaktifkan saat turun atau mendarat. Semua ini terjadi pada tekanan atmosfer, yang seharusnya konstan pada ketinggian tertentu tidak jauh dari permukaan.
 Gambar 4. Balon udara panas. Sumber: Pixabay.
Gambar 4. Balon udara panas. Sumber: Pixabay. Boiler
Di boiler, uap dihasilkan dengan memanaskan air dan menjaga tekanan konstan. Kemudian uap ini melakukan pekerjaan yang dapat digunakan, misalnya menghasilkan listrik di pembangkit termoelektrik atau bertindak mekanisme lain seperti lokomotif dan pompa air.
Latihan terpecahkan
Latihan 1
Ada 40 liter gas pada suhu 27 ° C. Temukan peningkatan volume saat menambahkan panas secara isobárically sampai mencapai 100 ºC.
Larutan
Hukum Charles digunakan untuk menentukan volume akhir, tetapi perhatian: suhu harus diekspresikan dalam Kelvin, cukup tambahkan 273 K ke masing -masing:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Dari:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 L/300 K) = 49.7 l
Akhirnya peningkatan volume adalah V2 - V1 = 49.7 L - 40 L = 9.7 l.
Latihan 2
5 disediakan 5.00 x 103 J dari energi ke gas ideal untuk membuat 2.00 x 103 J pekerjaan di lingkungan Anda dalam proses isobarik. Itu diminta untuk menemukan:
a) Perubahan energi internal gas.
b) Perubahan volume, jika sekarang energi internal berkurang dengan 4.50 x 103 J dan 7 diusir.50 x 103 J dari sistem, mempertimbangkan tekanan konstan 1.01 x 105 Pa.
Solusi untuk
Digunakan ∆U = q - w dan nilai -nilai yang diberikan dalam pernyataan itu diganti: Q = 5.00 x 103 J dan w = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Oleh karena itu energi internal gas meningkat 3.00 x 103 J.
Solusi b
Perubahan volume ditemukan dalam pekerjaan yang dilakukan: W = P∆V:
∆U = q - w = q - P∆V
Pernyataan itu menegaskan bahwa energi internal berkurang, oleh karena itu: ∆U= -4.50 x 103 J. Ini juga memberi tahu kita bahwa sejumlah panas dikeluarkan: q = -7.50 x 103 J. Dalam kedua kasus, tanda negatif mewakili penurunan dan kerugian, kemudian:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Di mana P = 1.01 x 105 Pa. Karena semua unit berada dalam sistem internasional, perubahan volume jelas:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pa) = -2.97 x 10-2 M3
Karena perubahan volume negatif, itu berarti bahwa volume menurun, yaitu sistem yang dikontrak.
Referensi
- Byjou's. Proses isobarik. Pulih dari: byjus.com.
- Cengel, dan. 2012. Termodinamika. Edisi ke -7. Bukit McGraw.
- Proses xyz. Pelajari lebih lanjut tentang proses isobarik. Pulih dari: 10 Proses.X dan z.
- Serway, r., Vulle, c. 2011. Dasar -dasar fisika. 9NA ed. Pembelajaran Cengage.
- Wikipedia. Hukum gas. Pulih dari: is.Wikipedia.org.
- « 14 eksperimen psikologis dengan manusia yang sangat kontroversial
- Konsep, Jenis, dan Contoh Embulisi »

