Komponen solusi isotonik, persiapan, contoh
- 4563
- 912
- Pete Lesch
A solusi isotonik Ini adalah salah satu yang menyajikan konsentrasi zat terlarut yang sama sehubungan dengan larutan yang dipisahkan atau diisolasi oleh bug semipermeabel. Penghalang ini memungkinkan pelarut untuk Transte, tetapi tidak semua partikel terlarut.
Dalam fisiologi, solusi yang terisolasi ini mengacu pada cairan intraseluler, yaitu interior sel; Sedangkan penghalang semipermeable sesuai dengan membran sel, dibentuk oleh lipid bilay.
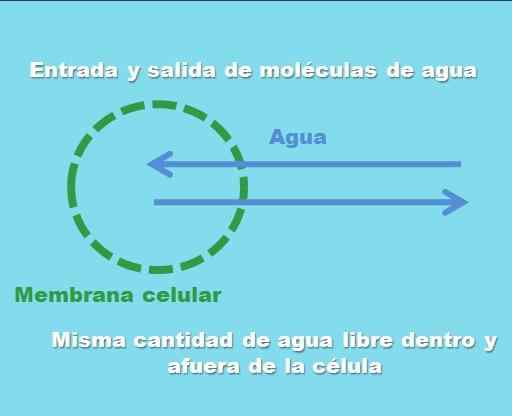
 Interaksi sel dengan solusi isotonik. Sumber: Gabriel Bolívar.
Interaksi sel dengan solusi isotonik. Sumber: Gabriel Bolívar. Gambar superior menggambarkan apa yang dimaksud dengan solusi isotonik. "Konsentrasi" air adalah sama di dalam dan di luar sel, sehingga molekulnya masuk atau keluar melalui membran sel dengan frekuensi yang sama. Oleh karena itu, jika dua molekul air memasuki sel, dua di antaranya akan berangkat secara bersamaan ke media ekstraseluler.
Keadaan ini, yang disebut isotonisitas, hanya terjadi ketika media berair, di dalam dan di luar sel, mengandung jumlah partikel zat terlarut yang sama. Dengan demikian, solusi akan menjadi isotonik jika konsentrasi zat terlarutnya mirip dengan cairan atau media intraseluler. Misalnya, larutan salin 0,9% adalah isotonik.
[TOC]
Komponen solusi isotonik
Agar ada solusi isotonik, pertama -tama harus memastikan bahwa osmosis terjadi dalam larutan atau pelarut. Ini hanya mungkin jika ada penghalang semipermeabel, yang memungkinkan molekul pelarut untuk mentransfernya, tetapi tidak pada zat terlarut, terutama zat terlarut yang dimuat secara elektrik, ion.
Dengan demikian, zat terlarut tidak dapat disebarkan dari daerah yang lebih terkonsentrasi ke daerah yang lebih encer. Sebaliknya, itu akan menjadi molekul air yang akan berpindah dari satu tempat ke tempat lain, melintasi penghalang semipermeabel, dan terjadi osmosis. Dalam sistem air dan biologis penghalang ini adalah par excellence, membran sel.
Dapat melayani Anda: kompetisi (biologi): karakteristik, jenis, contohMemiliki penghalang semipermeabel dan media pelarut, adanya ion atau garam terlarut di kedua media juga diperlukan: internal (di dalam penghalang), dan eksternal (di luar penghalang).
Jika konsentrasi ion -ion ini sama di kedua sisi, maka tidak akan ada kelebihan atau defisit molekul air untuk menyelesaikannya. Yaitu, jumlah molekul bebas air adalah sama, dan oleh karena itu, mereka tidak akan mentransfer penghalang semipermeabel di mana pun dengan tujuan mencocokkan konsentrasi ion.
Persiapan
- Kondisi dan persamaan
Meskipun solusi isotonik dapat disiapkan dengan pelarut apa pun, karena air adalah media sel, ini dianggap sebagai pilihan favorit. Mengetahui persis konsentrasi garam dalam tubuh tubuh tertentu, atau dalam aliran darah, dimungkinkan untuk memperkirakan berapa banyak garam yang harus larut dalam volume yang diberikan.
Pada organisme vertebrata diterima bahwa, rata -rata, konsentrasi zat terlarut dalam plasma darah adalah sekitar 300 mosm/L (miliosmolaritas), mampu menafsirkan hampir 300 mmol/L/L/L. Artinya, ini adalah konsentrasi yang sangat encer. Untuk memperkirakan miliosmolaritas, persamaan berikut harus diterapkan:
Osmolaritas = m · v · g
Untuk tujuan praktis diasumsikan itu G, Koefisien osmotik, memiliki nilai 1. Sehingga persamaannya sekarang sebagai:
Osmolaritas = m · v
Di mana M Itu adalah molaritas zat terlarut, dan v Jumlah partikel di mana zat terlarut tersebut terdisosiasi di dalam air. Kemudian, kami melipatgandakan nilai ini dengan 1.000 untuk mendapatkan miliosmolaritas untuk zat terlarut tertentu.
Dapat melayani Anda: apa itu homoplasia? (Dengan contoh)Jika ada lebih dari satu zat terlarut, total miliosolaritas dari larutan akan menjadi jumlah seribu untuk setiap zat terlarut. Semakin banyak zat terlarut sehubungan dengan interior sel, semakin sedikit isotonik akan menjadi solusi yang disiapkan.
- Contoh persiapan
Misalkan Anda ingin menyiapkan satu liter solusi isotonik berdasarkan glukosa dan natrium diácid fosfat. Berapa berat glukosa? Asumsikan bahwa 15 gram NAH akan digunakan2PO4.
Langkah pertama
Pertama -tama kita harus menentukan nah osmolarity2PO4 menghitung molaritasnya. Untuk melakukan ini, kami beralih ke massa molar atau berat molekulnya, 120 g/mol. Karena kami diminta satu liter solusi, kami menentukan tahi lalat dan kami akan secara langsung memiliki molaritas:
Mol (nah2PO4) = 15 g ÷ 120g/mol
= 0,125 mol
M (nah2PO4) = 0,125 mol/L
Tapi saat nah2PO4 Itu larut dalam air, melepaskan kation+ dan anion h2PO4-, karena itu v Ini memiliki nilai 2 dalam persamaan osmolaritas. Kami melanjutkan untuk menghitung kemudian untuk Nah2PO4:
Osmolaritas = m · v
= 0,125 mol/l · 2
= 0,25 OSM/L
Dan dengan mengalikannya dengan 1.000 kita memiliki miliosmolaritas nah2PO4:
0,25 OSM/L · 1.000 = 250 mosm/l
Tahap kedua
Karena total miliosolaritas larutan harus sama dengan 300 mosm/L, kami mengurangi untuk mengetahui apa seharusnya glukosa:
mosm/l (glukosa) = mosm/l (total) - mosm/l (nah2PO4)
= 300 mosm/l - 250 mosm/l
= 50 mosm/l
Karena glukosa tidak terpisah, v Vale 1 dan osmolaritasnya sama dengan molaritasnya:
M (glukosa) = 50 mosm/l ÷ 1.000
= 0,05 mol/L
Menjadi molar glukosa 180 g/mol, kami akhirnya menentukan berapa banyak gram yang harus kami bimbang untuk melarutkannya dalam liter solusi isotonik:
Dapat melayani Anda: renina: struktur, produksi, sekresi, fungsiMassa (glukosa) = 0,05 mol · 180 g/mol
= 9 g
Oleh karena itu, solusi isotonik nah ini2PO4/Glukosa mempersiapkan 15 gram Nah2PO4 dan 9 gram glukosa dalam satu liter air.
Contoh solusi isotonik
Solusi atau cairan isotonik tidak menyebabkan gradien atau perubahan konsentrasi ion dalam tubuh, sehingga tindakan mereka pada dasarnya berfokus pada pasien yang menerimanya jika terjadi pendarahan atau dehidrasi.
Saline normal
Salah satu solusi ini adalah saline normal, dengan konsentrasi NaCl 0,9%.
Solusi laktat ringer
Solusi isotonik lain yang digunakan untuk tujuan yang sama adalah ringer laktat, yang mengurangi keasaman karena komposisi buffer atau redamannya, dan larutan fosfat Sorensen, yang terdiri dari fosfat dan natrium klorida.
Sistem Non -Aqueous
Isotonisitas juga dapat diterapkan pada sistem non -aqueous, seperti di mana pelarut adalah alkohol; Selama, ada penghalang semipermeabel yang mendukung transparansi molekul alkohol dan mempertahankan partikel zat terlarut.
Referensi
- Dari lehr spilva, ke. Dan muktans, dan. (1999). Panduan untuk Spesialisasi Farmasi di Venezuela. Edisi XXXVª. Edisi Global.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Elsevier b.V. (2020). Solusi isotonik. Diperoleh dari: Scientedirect.com
- Adrienne Brundage. (2020). Solusi Isotonik: Definisi & Contoh. Belajar. Pulih dari: belajar.com
- Felicitas merino de la hoz. (S.F.). Seroterapi intravena. Universitas Cantabria. [PDF]. Pulih dari: ocw.Unican.adalah
- Laboratorium farmasi dan peracikan. (2020). Persiapan Ophthalmic: Buffer Isotonik. Pulih dari: pharmlabs.UNC.Edu

