Barium oksida (BAO) Struktur, sifat, penggunaan, risiko

- 802
- 201
- Leland Robel
Dia Barium oksida Ini adalah padatan anorganik yang dibentuk oleh atom barium (BA) dan atom oksigen (O). Formula kimianya adalah Bao. Ini adalah padatan kristal putih dan higroskopis, yaitu, ia menyerap kelembaban udara, tetapi dengan melakukan itu bereaksi dengan ini.
Reaksi cepat barium oksida dengan air membuatnya digunakan di laboratorium analisis kimia, yaitu menghilangkan air dari pelarut organik, yang merupakan senyawa cair yang berfungsi untuk melarutkan zat lain.
 Bao Barium oksida padat. Lem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Bao Barium oksida padat. Lem [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Bao berperilaku seperti basa yang kuat, oleh karena itu bereaksi dengan banyak jenis asam. Misalnya mudah bereaksi dengan karbon dioksida2 dari udara untuk membentuk Bacchus barium karbonat3.
Itu berfungsi dalam pembuatan polimer untuk kabel listrik dan sebagai bahan resin untuk menyegel lubang gigi yang telah disembuhkan.
Barium oksida (BAO) juga digunakan dalam industri keramik, baik untuk menutupinya dengan kaca dan untuk memproduksinya. Ini juga digunakan dalam campuran semen untuk meningkatkan resistensi kompresi dari produk akhir.
[TOC]
Struktur
Bao Baar Oxide dibentuk oleh kation BA2+ dan anion oksigen atau2-.
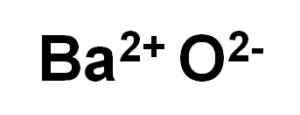 Ion Bao Barium Oksida. Penulis: Marilú Stea.
Ion Bao Barium Oksida. Penulis: Marilú Stea. Dalam kristalnya, Bao membentuk jaringan ionik kubik (dalam bentuk kubus) dari jenis natrium klorida.
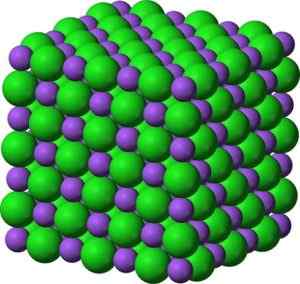 Struktur kristal berbentuk Bao Barium oksida mirip dengan natrium klorida. Hijau: Barium. Biru: Oksigen. Benjah-bmm27 (bicara · contribs) [domain publik]. Sumber: Wikimedia Commons.
Struktur kristal berbentuk Bao Barium oksida mirip dengan natrium klorida. Hijau: Barium. Biru: Oksigen. Benjah-bmm27 (bicara · contribs) [domain publik]. Sumber: Wikimedia Commons. Konfigurasi elektronik ion barium adalah: [xe] 6s0 Nah, dua elektron lapisan 6s telah hilang. Konfigurasi ini sangat stabil.
Tata nama
-Barium oksida
-Barium monoksida
Itu dapat melayani Anda: Tes: Karakteristik, Jenis, Contoh PenggunaanProperti fisik
Keadaan fisik
Padatan kristal putih kekuningan.
Berat molekul
153.33 g/mol
Titik lebur
1923 ºC
Titik didih
Sekitar 2000 ºC.
Kepadatan
5.72 g/cm3
Kelarutan
Little Water Soluble: 3,8 g/100 ml pada 20 ºC.
Sifat kimia
Bario Bao Oksida bereaksi cepat2, yang merupakan hidroksida yang paling larut antara hidroksida logam alkalineteric.
Bao + H2O → BA (OH)2
Bao adalah basis yang kuat. Bereaksi eksotermicly (yaitu, dengan detasemen panas) dengan semua jenis asam.
Dengan co2 Bao bereaksi untuk membentuk bacchus barium karbonat3.
Bao + co2 → Bacchus3
Bao higroskopis, karena jika diizinkan ke lingkungan, secara bertahap bergabung dengan kelembaban udara, membentuk BA (OH)2 yang dikombinasikan dengan karbon dioksida2 udara untuk memberi barium karbonat bacchus3.
Saat bao barium monoksida dipanaskan di hadapan udara, ia dikombinasikan dengan oksigen yang membentuk barium peroksida Bao2. Reaksinya reversibel.
2 bao + o2 ⇔ 2 Bao2
Di hadapan air, ia dapat bereaksi dengan aluminium ke atau dengan FIFC Zn membentuk oksida atau hidroksida logam ini dan menghasilkan gas hidrogen h2.
Anda dapat memulai polimerisasi senyawa organik yang dapat dipolimerisasi, seperti epoksida.
Risiko
Itu bisa beracun saat menelan. Anda tidak boleh menghubungi kulit. Itu adalah mata, kulit, dan saluran pernapasan yang menjengkelkan. Ini bisa berbahaya bagi sistem saraf. Itu mampu menyebabkan kadar kalium yang rendah, mengakibatkan gangguan jantung dan otot.
Memperoleh
Bao barium oksida dapat diperoleh dengan memanaskan bario baco karbonat3 Dengan batubara. BAO terbentuk dan gas karbon monoksida dilepaskan.
Bacchus3 + C → BAO + 2 CO ↑
Aplikasi
Sebagai pengeringan pelarut organik
Karena kemudahannya untuk bereaksi dengan air, BAO telah digunakan sejak pertengahan abad terakhir sebagai pengeringan bensin dan pelarut organik dasar.
Itu dapat melayani Anda: asam cyanhydric: struktur molekul, sifat, penggunaanBAO sangat pengeringan di sekitarnya, dibutuhkan kelembaban dengan sangat cepat, dengan evolusi panas yang cukup, membentuk barium hidroksida ba (OH)2 yang stabil hingga sekitar 1000 ºC. Oleh karena itu BAO dapat digunakan pada suhu tinggi.
Ini juga memiliki kapasitas penyerapan air yang tinggi. Untuk setiap molekul BAO, seseorang dapat menyerap air dan BA (OH)2 yang dihasilkan juga dapat menyerap sejumlah air.
Itu cocok untuk laboratorium kimia analitik. Itu tidak lengket.
Ini dapat digunakan dalam pengeringan, yang merupakan wadah kaca besar dengan tutup di mana atmosfer internal kering dipertahankan. Bao menjaga miniatmosphere dari desikator tetap kering.
 Disinter di laboratorium. Padatan pengering seperti Bao ditempatkan di bagian bawah pangkalan. Pengunggah asli adalah Rifleman 82 di Wikipedia Inggris. [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Disinter di laboratorium. Padatan pengering seperti Bao ditempatkan di bagian bawah pangkalan. Pengunggah asli adalah Rifleman 82 di Wikipedia Inggris. [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons. Desikator ini berfungsi untuk menempatkan zat atau reagen dan dengan demikian mencegah mereka menyerap air dari lingkungan.
Ini juga berfungsi untuk mengeringkan gas dasar seperti amonia NH3.
Di Lampu Unduh
BAO ditempatkan di elektroda lampu pelepasan sebagai bahan pemancar elektron.
Lampu pelepasan dibentuk oleh tabung gelas, kuarsa atau bahan yang cocok lainnya, berisi gas inert dan dalam kebanyakan kasus uap logam. Uap logam bisa menjadi natrium atau merkuri.
 Lampu Merkurius. Dmitry G [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Lampu Merkurius. Dmitry G [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Di dalam tabung, sengatan listrik terjadi karena memiliki elektroda positif dan negatif.
Bao ditempatkan di elektroda lampu. Elektron dipancarkan bertabrakan dengan atom uap logam dan mentransmisikan energi.
Itu bisa melayani Anda: cupric oxide (cuo)Saat melewati arus listrik melalui gas atau uap ini ada cahaya yang terlihat atau radiasi ultraviolet (UV).
Dalam manufaktur keramik
Bao digunakan dalam komposisi pelapis keramik mengkilap.
 Fasad bangunan yang dilapisi dengan keramik kaca. Penny Mayes/Glazed Fasade. Sumber: Wikimedia Commons.
Fasad bangunan yang dilapisi dengan keramik kaca. Penny Mayes/Glazed Fasade. Sumber: Wikimedia Commons. Namun, itu juga telah diuji sebagai aditif dalam persiapan hob.
BAO secara efektif meningkatkan karakteristik mekanis dan ketahanan kimia dari jenis keramik ini. Ini memiliki pengaruh yang kuat pada sifat termal dan komposisi fase kristal bahan yang diperoleh.
Dalam persiapan campuran semen
Bao telah diuji sebagai komponen semen fosfoaluminasi.
Jenis semen ini berguna di lingkungan laut, karena tidak memiliki kecenderungan yang sama untuk melembabkan seperti jenis semen lainnya, sehingga tidak menderita pori atau ekspansi.
Namun, semen fosfoaluminasi perlu diperkuat dalam kinerja mekaniknya agar dapat menahan arus laut dan pukulan es mengambang yang ada di laut.
Penambahan BAO ke semen fosfoaluminasi memodifikasi struktur mineral material tersebut, meningkatkan struktur pori -pori dan sangat meningkatkan gaya tekan pasta semen.
Dengan kata lain, BAO meningkatkan resistensi kompresi jenis semen ini.
 Campur untuk beton. Bao Barium oksida berguna untuk meningkatkan sifat semen tertentu. Thamizhparithi Maari [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Campur untuk beton. Bao Barium oksida berguna untuk meningkatkan sifat semen tertentu. Thamizhparithi Maari [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Dalam beberapa aplikasi
Ini digunakan sebagai bahan untuk memberikan opacity dalam resin gigi untuk mengisi lubang di gigi, dilakukan oleh dokter gigi.
Ini juga digunakan sebagai zat nukleasi untuk persiapan polimer polivinilidena fluorida yang digunakan untuk mengisolasi kabel listrik.
Referensi
- Partyka, J. et al. (2016). Pengaruh Penambahan BAO pada Sintering Bahan Gelas-Keramik dari SIO2-Ke2SALAH SATU3-Na2OKE2Sistem O-CAO/MGO. J Therm Anal Calim (2016) 125: 1095. Tautan pulih.Peloncat.com.
- Zhang, hlm. et al. (2019). Efek BAO pada struktur mineral dan perilaku hidrasi semen fosfoaluminasi. J Therm Anal Calim (2019) 136: 2319. Tautan pulih.Peloncat.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Barium oksida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Smith, n.KE. (2003). Petir. Prinsip. Dalam buku referensi insinyur listrik (edisi keenam belas). Pulih dari scientedirect.com.
- Ebnejjad, s. (2003). Busa fluoropolymer. PVDF berbusa. Dalam melelehkan fluoroplastik yang dapat diproses. Pulih dari scientedirect.com.
- Booth, h.S. dan McIntyre, L.H. (1930). Barium oksida sebagai pengeringan. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Pulih dari pub.ACS.org.
- « Struktur Sodium Cyanide (NACN), Properti, Risiko, Penggunaan
- 15 makanan terbaik untuk meningkatkan bokong (alami) »

