Sifat klorin oksida (V), struktur, penggunaan

- 2456
- 707
- Dewey Runolfsdottir
Dia Klorin oksida (V) Itu adalah senyawa anorganik yang sangat tidak stabil yang formula kimianya adalah cl2SALAH SATU5. Ini adalah salah satu dari banyak oksida klorin, yang ditandai dengan menjadi molekuler, atau bahkan spesies radikal.
Cl2SALAH SATU5 Dia hanya menemukan kehidupan di atas kertas dan perhitungan teoretis; Namun, keberadaannya belum dikesampingkan dan kemungkinan beberapa orang dapat dikarakterisasi (dengan teknik spektroskopi canggih)). Apa karena konsep umum kimia dapat diprediksi dari oksida ini, adalah bahwa anhidrida asam klorat, hclo3.
 Molekul CL2O5. Sumber: Jynto [CC0].
Molekul CL2O5. Sumber: Jynto [CC0]. Molekul oksida klorin hipotetis (V) ditunjukkan di atas (V). Perhatikan bahwa karena itu adalah molekul, keberadaan CL+5; Bahkan kurang ketika ia harus memiliki kekuatan polarisasi untuk memaksa oksigen, menghubungkan secara kovalen.
Seperti senyawa yang tidak stabil, ia melepaskan energi untuk terurai dalam produk yang lebih stabil; memproses yang dalam banyak kasus bersifat eksplosif. Saat Cl2SALAH SATU5 Itu menghancurkan kebebasan2 SAYA2. Teori bahwa di dalam air, tergantung pada isomer CL2SALAH SATU5, Beberapa oxoacid klorin dapat dibentuk.
[TOC]
Properti
Massa molar CL2SALAH SATU5 adalah 150.9030 g/mol. Dari massa ini, dan molekul hipotetisnya, dapat diduga bahwa jika dapat diisolasi itu mungkin akan menjadi cairan berminyak; Tentu saja, membandingkannya dengan penampilan fisik CL2SALAH SATU7.
Meskipun tidak dapat diisolasi atau dikarakterisasi, oksida klorin ini bersifat asam, kovalen dan juga harus memiliki momen dipol kecil. Keasamannya dapat dimengerti jika persamaan kimianya dari hidrolisisnya dianalisis:
Dapat melayani Anda: hukum amagat: penjelasan, contoh, latihanCl2SALAH SATU5 + H2Atau 2hclo3
Menjadi HCLO3 Asam klorat. Reaksi terbalik akan menghasilkan kasus bahwa asam dapat mengalami dehidrasi:
2hclo3 => Cl2SALAH SATU5 + H2SALAH SATU
Di sisi lain, saat CL2SALAH SATU5 Segera setelah itu terjadi, ia membusuk:
2cl2SALAH SATU5 => 4clo2 + SALAH SATU2
Oleh karena itu adalah spesies perantara, bukan oksida dengan benar. Dekomposisi harus begitu cepat (mengingat bahwa CL bahkan terbentuk2SALAH SATU5), yang tidak dapat dideteksi dengan teknik analisis instrumental saat ini.
Struktur oksida klorin (V)
Molekul
Pada gambar atas, struktur molekul CL hipotetis ditunjukkan2SALAH SATU5 Dengan model bola dan batang. Bola merah mewakili atom oksigen, dan hijau ke klorin. Setiap klorin memiliki lingkungan piramida trigonal, sehingga hibridisasi harus SP3.
Dengan demikian, molekul CL2SALAH SATU5 Itu dapat dilihat sebagai dua piramida trigonal yang dihubungkan oleh oksigen. Tetapi jika diamati dengan cermat, piramida memandu atom oksigennya ke bawah, dan yang lain keluar dari pesawat (ke arah pembaca).
Dari sini diduga ada rotasi di tautan atau2CL-O-Cl2, membuat molekul relatif dinamis. Perhatikan bahwa formula atau2Cloclo2 Ini adalah cara untuk mewakili struktur CL2SALAH SATU5.
Struktur Lewis
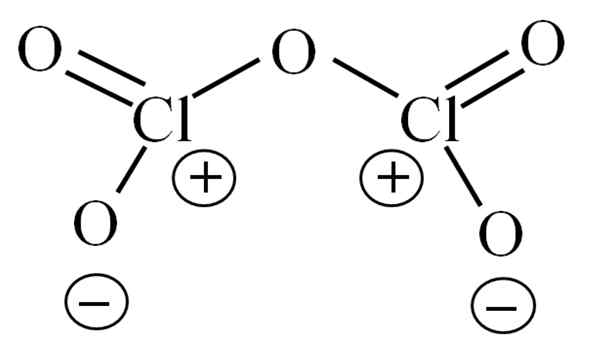 Struktur Lewis untuk CL2O5 hipotetis. Sumber: Gabriel Bolívar.
Struktur Lewis untuk CL2O5 hipotetis. Sumber: Gabriel Bolívar. Sampai sekarang molekul itu sendiri tidak memungkinkan menguraikan apa yang disebabkan oleh ketidakstabilannya. Untuk menjelaskan pertanyaan ini, struktur Lewisnya digunakan, diwakili di atas. Perhatikan bahwa itu dapat dianggap salah bahwa strukturnya datar, tetapi di bagian anterior, diklarifikasi bahwa tidak demikian.
Dapat melayani Anda: natrium azid (nan3): struktur, sifat, penggunaan, risikoMengapa kedua atom klorin memiliki beban formal yang positif? Karena klorin memiliki sepasang elektron, yang dapat diverifikasi ketika teori tautan valencia diterapkan (yang karena penyederhanaan tidak akan dilakukan di sini). Dengan demikian, beban formalnya adalah:
CF = 7 - (4 + 2) = 1
Dan apa hubungannya ini dengan ketidakstabilan Anda? Nah, klorin sangat elektronegatif, dan oleh karena itu pembawa yang buruk dari beban formal positif. Ini kembali ke CL2SALAH SATU5 Spesies yang sangat asam, karena perlu mendapatkan elektron untuk memasok permintaan elektronik dari dua kloro.
Sebaliknya terjadi dengan BR2SALAH SATU5 dan i2SALAH SATU5, oksida yang ada dalam kondisi normal. Ini karena bromin dan yodium kurang elektronegatif daripada klorin; Dan karena itu, mereka mendukung beban formal yang positif lebih baik.
Isomer dan hidrolisis masing -masing
Sejauh ini seluruh penjelasan telah jatuh ke salah satu dari dua isomer CL2SALAH SATU5: O2Cloclo2. Yang lainnya? O3Cloclo. Dalam isomer ini kloros tidak memiliki beban formal yang positif, dan karenanya harus menjadi molekul yang lebih stabil. Namun, keduanya atau2Cloclo2 seperti o3Cloclo harus menderita reaksi hidrolisis:
SALAH SATU2CL-O-Cl2 + H2O => 2nd2Cl-oh (yang tidak lebih dari HCLO3)
SALAH SATU3CL-O-CLO + H2O => o3Cl-oh (hclo4) + Ho-clo (hclo2)
Perhatikan bahwa hingga tiga oxoacid klorin dapat dibentuk: hclo3, Hclo4 Dan hclo2
Tata nama
Namanya 'Chlorine Oxide (V)' sesuai dengan yang ditugaskan sesuai dengan nomenklatur stok. Cl2SALAH SATU5 Ini juga dapat memiliki dua nama lain: Dicloro dan cloring anhydride pentaoxide, masing -masing yang ditugaskan oleh nomenklatif sistematis dan tradisional, masing -masing.
Dapat melayani Anda: titanium: sejarah, struktur, sifat, reaksi, penggunaanAplikasi
Lebih dari memotivasi studi komputer, CL2SALAH SATU5 Itu akan kurang digunakan sampai ditemukan, terisolasi, dikarakterisasi, disimpan dan telah menunjukkan bahwa itu tidak meledak dengan sedikit kontak.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Sandra Luján Quiroga dan Luis José Perissinotti. (2011). Klorin Oxoacids dan Struktur Dichlorine Oksida. Chem. Pendidik, Vol. 16.
- Formulasi Kimia. (2019). Klorin oksida (V). Pulih dari: formulasi quimica.com
- Linus Pauling. (1988). Kimia Umum. Dover Publications, Inc., New York.
- Richard c. Ropp. (2013). Encyclopedia dari senyawa bumi alkali. Elsevier.
- « Latar belakang dan karakteristik neolamarckisme
- Struktur besi hidroksida (II), sifat, penggunaan »

